题目内容
10.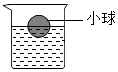 将一个塑料小球放入盛有AgNO3溶液的烧杯中,小球悬浮于液面,位置如图.将一定质量的铜片放入烧杯中,充分反应后(溶液的体积几乎不变),烧杯中出现哪些现象?写出发生的化学反应方程式.
将一个塑料小球放入盛有AgNO3溶液的烧杯中,小球悬浮于液面,位置如图.将一定质量的铜片放入烧杯中,充分反应后(溶液的体积几乎不变),烧杯中出现哪些现象?写出发生的化学反应方程式.
分析 根据金属的化学性质并结合物理学中浮力的有关知识进行分析.
解答 解:铜和硝酸银溶液反应生成硝酸铜溶液和银,反应的化学方程式为:Cu+2AgNO3═Cu(NO3)2+2Ag;
从方程式可以看出,将一定质量的铜片放入烧杯中,充分反应后溶液质量减小,而溶液体积几乎不变,因此溶液密度减小,小球受到的浮力依然等于球的质量,根据F浮=ρgv排,则可知小球浸入溶液的体积变大.
故答案为:铜片表面有银白色金属析出,小球浸入溶液的体积变大;Cu+2AgNO3═Cu(NO3)2+2Ag.
点评 学科的结合增大了问题的难度,只要把握了物质所受浮力大小与溶液的密度密切相关,就可以把思考引向问题的关键:反应前后溶液质量的变化.

练习册系列答案
相关题目
15.推理是一种重要的学习方法,以下是某同学对所学化学知识的一些推理,其中合理的是( )
| A. | 碳酸盐与稀盐酸反应能产生气体,所以与稀盐酸反应产生气体的物质一定是碳酸盐 | |
| B. | 碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液都是碱性溶液 | |
| C. | 燃烧一般都伴随发光、放热现象,所以有发光、放热现象的变化就是燃烧 | |
| D. | 中和反应一定有盐和水生成,所以有盐和水生成的反应一定是中和反应 |
2.在制取CO2的实验中,小科发现质量相同而粗细不同的大理石与盐酸反应,CO2的产生速度细的比粗的快得多.经思考后,小科设计了如下实验(每次实验均用1g大理石,20mL盐酸)
(1)为了比较反应速度,设计如图一所示装置,其中量筒的作用是通过观察单位时间内排入量筒中水的体积来判断反应速率;
(2)实验中CO2体积随时间的变化关系如图二所示,请将实验2中CO2体积随时间变化的曲线画在图二中.
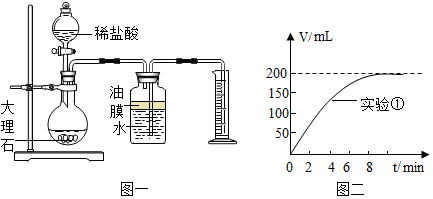
(3)已知20℃该气压下CO2气体密度约1.98g/L,求大理石中CaCO3的质量分数?(详细计算过程)(C-12 O-16 Ca-40)
| 实验序号 | 温度(℃) | 大理石颗粒 | 盐酸质量分数(%) | 实验目的 |
| 1 | 20 | 粗 | 5 | 探究大理石和盐酸的反应速度与石灰石颗粒大小的关系 |
| 2 | 20 | 细 | 5 |
(2)实验中CO2体积随时间的变化关系如图二所示,请将实验2中CO2体积随时间变化的曲线画在图二中.

(3)已知20℃该气压下CO2气体密度约1.98g/L,求大理石中CaCO3的质量分数?(详细计算过程)(C-12 O-16 Ca-40)
20.金属钴(Co)与铁的化学性质相似,都能与稀盐酸反应,在化合物中钴元素常显+2,+3价,下列说法正确的是( )
| A. | CoCl3读作“氯化亚钴” | |
| B. | 补充钴元素可以防止贫血 | |
| C. | 金属铜不能与CoCl2溶液发生反应 | |
| D. | CoCl2中钴元素的质量分数约为33.3% |
 我们每天摄入的食物不仅要保证一定的数量,还要注意合理搭配,以保证各种营养素的均衡摄入.“营养平衡膳食宝塔”为我们提供了合理选择食物的指南.请回答问题:
我们每天摄入的食物不仅要保证一定的数量,还要注意合理搭配,以保证各种营养素的均衡摄入.“营养平衡膳食宝塔”为我们提供了合理选择食物的指南.请回答问题:

