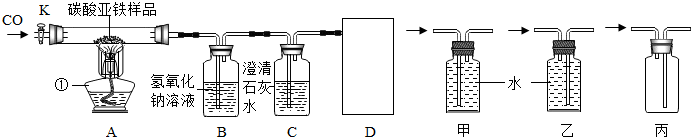
题目内容
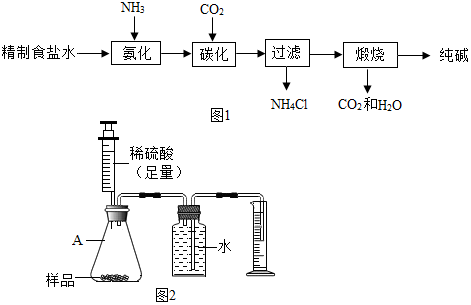
18.某碱厂年产纯碱120万吨,它的产品除了纯碱外,还有氯化钙和碳酸氢钠.该厂生产纯碱的工艺流程可简单表示如下:
其生产过程中涉及的主要化学反应有:
①NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
请回答:
(1)①“碳化”过程中需要的CO2,可由石灰石高温煅烧得到,该反应的化学方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
②实验室中,通常用稀盐酸与石灰石反应制取CO2气体,不选用浓盐酸的理由是浓盐酸易挥发;干燥CO2气体,可用的干燥剂是A(填字母).
A.浓硫酸 B.固体氢氧化钠 C.生石灰
(2)①该厂“过滤”所得的NH4Cl可作化肥中的氮肥,该厂的另一种产品碳酸氢钠俗称小苏打,它的重要用途有治疗胃酸过多(只写一种).
②实验室进行“过滤”操作时,下列说法正确的有BD(填字母)
A.使用的漏斗叫长颈漏斗 B.液面应低于滤纸边缘
C.玻璃棒应不停搅拌 D.漏斗下端的管口要紧靠烧杯内壁
(3)某化学兴趣小组的同学为了测定该厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计了如下两种实验方案:
方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤,干燥得固体19.70g.通过计算(写出计算过程)判断该厂的产品是否属于优等品.(杂质可溶于水且 不与氯化钡反应)
方案二:用如图所示的装置收集,通过准确测量排出水的体积,也可计算样品的纯度.该装置中仪器A的名称是锥形瓶,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是二氧化碳部分溶于水,导管中有水等.(装置的气密性良好)

分析 (1)高温条件下,碳酸钙分解生成氧化钙和二氧化碳;
浓盐酸易挥发;
浓硫酸具有吸水性,不能和二氧化碳反应,氢氧化钠和二氧化碳反应生成碳酸钠和水,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水;
(2)氯化铵中含有氮元素,可以用作氮肥;
该厂的另一种产品碳酸氢钠俗称小苏打,它的重要用途有用作发酵粉、治疗胃酸过多等;
②实验室进行“过滤”操作时,液面应低于滤纸边缘,漏斗下端的管口要紧靠烧杯内壁;
(3)碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,根据反应的化学方程式及其提供的数据可以进行相关方面的计算;
二氧化碳能够溶于水.
解答 解:(1)①“碳化”过程中需要的CO2,可由石灰石高温煅烧得到,该反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
故填:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
②实验室中,通常用稀盐酸与石灰石反应制取CO2气体,不选用浓盐酸的理由是浓盐酸易挥发,会导致二氧化碳中含有氯化氢气体;
干燥CO2气体,可用的干燥剂是浓硫酸,这是因为浓硫酸具有吸水性,不能和二氧化碳反应,氢氧化钠和二氧化碳反应生成碳酸钠和水,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水.
故填:浓盐酸易挥发;A.
(2)①该厂“过滤”所得的NH4Cl可作化肥中的 氮肥,该厂的另一种产品碳酸氢钠俗称小苏打,它的重要用途有用作发酵粉、治疗胃酸过多等.
故填:氮;小苏打;治疗胃酸过多.
②实验室进行“过滤”操作时,下列说法正确的有液面应低于滤纸边缘,漏斗下端的管口要紧靠烧杯内壁.
故填:BD.
(3)方案一:
解:设碳酸钠的质量为x,
BaCl2+Na2CO3═BaCO3↓+2NaCl,
106 197
x 19.70g
$\frac{106}{x}$=$\frac{197}{19.70g}$,
x=10.60g,
该厂产品中碳酸钠的质量分数为:$\frac{10.60g}{10.65g}$×100%=99.5%,
因为>99.2%,因此该厂的产品属于优等品.
方案二:
该装置中仪器A的名称是锥形瓶,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是二氧化碳部分溶于水,导管中有水等.
故填:锥形瓶;二氧化碳部分溶于水,导管中有水等.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

| A. |  铁生锈 | B. |  二氧化碳性质探究 | ||
| C. |  洗涤剂洗碗 | D. |  分子性质探究 |
| A. | 节约资源,节能减排 | B. | 重复利用,循环再生 | ||
| C. | 低碳环保,绿色出行 | D. | 铺张浪费,相互攀比 |
| A. | 钛合金表链 | B. | 纯棉手套 | C. | 手机塑料外壳 | D. | 真丝围巾 |
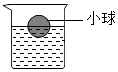 将一个塑料小球放入盛有AgNO3溶液的烧杯中,小球悬浮于液面,位置如图.将一定质量的铜片放入烧杯中,充分反应后(溶液的体积几乎不变),烧杯中出现哪些现象?写出发生的化学反应方程式.
将一个塑料小球放入盛有AgNO3溶液的烧杯中,小球悬浮于液面,位置如图.将一定质量的铜片放入烧杯中,充分反应后(溶液的体积几乎不变),烧杯中出现哪些现象?写出发生的化学反应方程式.