题目内容
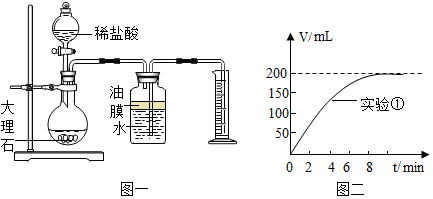
2.在制取CO2的实验中,小科发现质量相同而粗细不同的大理石与盐酸反应,CO2的产生速度细的比粗的快得多.经思考后,小科设计了如下实验(每次实验均用1g大理石,20mL盐酸)| 实验序号 | 温度(℃) | 大理石颗粒 | 盐酸质量分数(%) | 实验目的 |
| 1 | 20 | 粗 | 5 | 探究大理石和盐酸的反应速度与石灰石颗粒大小的关系 |
| 2 | 20 | 细 | 5 |
(2)实验中CO2体积随时间的变化关系如图二所示,请将实验2中CO2体积随时间变化的曲线画在图二中.
(3)已知20℃该气压下CO2气体密度约1.98g/L,求大理石中CaCO3的质量分数?(详细计算过程)(C-12 O-16 Ca-40)
分析 (1)其中量筒的作用是通过观察单位时间内排入量筒中水的体积来判断反应速率;
(2)反应物接触面积越大,反应速率越快;
(3)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据二氧化碳的体积、密度可以计算二氧化碳质量,根据二氧化碳质量可以计算碳酸钙质量,进一步可以计算大理石中CaCO3的质量分数.
解答 解:(1)为了比较反应速度,设计如图一所示装置,其中量筒的作用是通过观察单位时间内排入量筒中水的体积来判断反应速率.
故填:通过观察单位时间内排入量筒中水的体积来判断反应速率.
(2)实验中,反应物接触面积较大,反应速率较快,相比之下,反应需要时间短,CO2体积随时间变化的曲线如下图所示:
(3)设碳酸钙质量为x,
反应生成二氧化碳质量为:1.98g/L×0.2L=0.396g,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 0.396g
$\frac{100}{x}$=$\frac{44}{0.396g}$,
x=0.9g,
大理石中CaCO3的质量分数为:$\frac{0.9g}{1g}$×100%=90%,
答:大理石中CaCO3的质量分数为90%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
17.下列肥料属于复合肥料的是( )
| A. | KNO3 | B. | NH4HCO3 | C. | (NH4)2SO4 | D. | Ca3(PO4)2 |
13.2016年6月5日为世界环境日,倡导人们“可持续消费和生产”,下列做法不符合这一思想的是( )
| A. | 节约资源,节能减排 | B. | 重复利用,循环再生 | ||
| C. | 低碳环保,绿色出行 | D. | 铺张浪费,相互攀比 |
17.下列各组物质的名称、俗称、化学式均表示同一种物质的是( )
| A. | 硫酸铜晶体,胆矾,CuSO4•5H2O | B. | 氯化钠,苏打,NaCl | ||
| C. | 氢氧化钠,纯碱,NaOH | D. | 碳酸钙,生石灰,Ca(OH)2 |
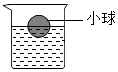 将一个塑料小球放入盛有AgNO3溶液的烧杯中,小球悬浮于液面,位置如图.将一定质量的铜片放入烧杯中,充分反应后(溶液的体积几乎不变),烧杯中出现哪些现象?写出发生的化学反应方程式.
将一个塑料小球放入盛有AgNO3溶液的烧杯中,小球悬浮于液面,位置如图.将一定质量的铜片放入烧杯中,充分反应后(溶液的体积几乎不变),烧杯中出现哪些现象?写出发生的化学反应方程式.