题目内容
高氯酸(HClO4)和亚氯酸钠(NaClO2)在工业上有广泛的用途,其制备工艺流程如图: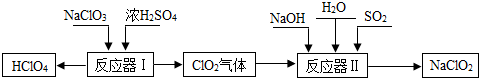
请回答下列问题:
(1)HClO4中Cl元素的化合价是 .
(2)反应器I中的生成物有HClO4、ClO2、NaHSO4、H2O,其中属于氧化物的是 .
(3)反应器Ⅱ中发生反应的化学方程式为2ClO2+SO2+4NaOH═2NaClO2+X+2H2O,则X的化学式是 .

请回答下列问题:
(1)HClO4中Cl元素的化合价是
(2)反应器I中的生成物有HClO4、ClO2、NaHSO4、H2O,其中属于氧化物的是
(3)反应器Ⅱ中发生反应的化学方程式为2ClO2+SO2+4NaOH═2NaClO2+X+2H2O,则X的化学式是
考点:物质的相互转化和制备,从组成上识别氧化物,有关元素化合价的计算,质量守恒定律及其应用
专题:物质的制备
分析:(1)根据化合物中化合价代数和为零去分析解答;
(2)根据氧化物是由两种元素组成的化合物中,其中一种是氧元素的化合物去分析解答;
(3)根据质量守恒定律:反应前后原子和种类和数量都不会改变去分析解答.
(2)根据氧化物是由两种元素组成的化合物中,其中一种是氧元素的化合物去分析解答;
(3)根据质量守恒定律:反应前后原子和种类和数量都不会改变去分析解答.
解答:解:(1)已知:H的化合价为:+1,O的化合价为:-2;
设Cl元素的化合价为x,
根据化合物中化合价代数和为零.
+1+x+(-2)×4=0
解之得:x=+7;故答案为:+7;
(2)氧化物是由两种元素组成的化合物中,其中一种是氧元素的化合物.
①HClO4是由H、Cl、O三种元素组成的,所以不是氧化物;
②ClO2是由Cl、O两种元素组成的,其中一种是氧元素,所以是氧化物;
③NaHSO4是由H、Na、S、O四种元素组成的,所以不是氧化物;
④H2O是由H、O两种元素组成的,其中一种是氧元素,所以是氧化物;
故属于氧化物的是ClO2和H2O;:故答案为:ClO2和H2O;
(3)根据质量守恒定律:反应前后原子和种类和数量都不会改变.由化学方程式为2ClO2+SO2+4NaOH=2NaClO2+X+2H2O,可知:反应前反应物中有:2个Cl原子、10个O原子、1个S原子和4个Na原子;而反应后已经有:2个Cl原子、6个O原子、1个S原子和2个Na原子;还少:4个O原子、1个S原子和2个Na原子,由于X前面的化学计量数为1,所以在一个X分子中应含有:4个O原子、1个S原子和2个Na原子,故其化学式为:Na2SO4;故答案为:Na2SO4.
设Cl元素的化合价为x,
| +1 x-2 |
| HClO4 |
根据化合物中化合价代数和为零.
+1+x+(-2)×4=0
解之得:x=+7;故答案为:+7;
(2)氧化物是由两种元素组成的化合物中,其中一种是氧元素的化合物.
①HClO4是由H、Cl、O三种元素组成的,所以不是氧化物;
②ClO2是由Cl、O两种元素组成的,其中一种是氧元素,所以是氧化物;
③NaHSO4是由H、Na、S、O四种元素组成的,所以不是氧化物;
④H2O是由H、O两种元素组成的,其中一种是氧元素,所以是氧化物;
故属于氧化物的是ClO2和H2O;:故答案为:ClO2和H2O;
(3)根据质量守恒定律:反应前后原子和种类和数量都不会改变.由化学方程式为2ClO2+SO2+4NaOH=2NaClO2+X+2H2O,可知:反应前反应物中有:2个Cl原子、10个O原子、1个S原子和4个Na原子;而反应后已经有:2个Cl原子、6个O原子、1个S原子和2个Na原子;还少:4个O原子、1个S原子和2个Na原子,由于X前面的化学计量数为1,所以在一个X分子中应含有:4个O原子、1个S原子和2个Na原子,故其化学式为:Na2SO4;故答案为:Na2SO4.
点评:计算反应前后原子的总数时,要注意化学式中前面的化学计量数.如:2ClO2中含有2×2=4个氧原子,而不是2个.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目

 某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.
某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.
 如图所示提供四种途径都可以得到氧气:
如图所示提供四种途径都可以得到氧气: