题目内容
硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO等,工艺流程简化示意图如图: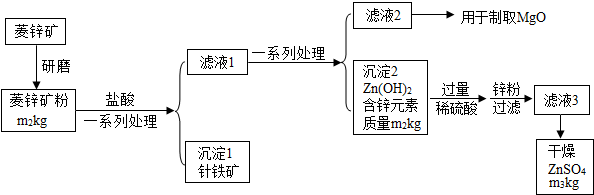
根据如图回答下列问题:
(1)将菱锌矿研磨成粉的目的是 .
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数:氧原子数:氢原子数= .
(3)请写出氢氧化锌和稀硫酸反应的化学方程式 .该反应的基本类型是
(4)“滤液3”之前加入锌粉的目的是
(5)“滤液3”之后的操作依次为 、干燥.
(6)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于 ×100%.

根据如图回答下列问题:
(1)将菱锌矿研磨成粉的目的是
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数:氧原子数:氢原子数=
(3)请写出氢氧化锌和稀硫酸反应的化学方程式
(4)“滤液3”之前加入锌粉的目的是
(5)“滤液3”之后的操作依次为
(6)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于
考点:物质的相互转化和制备,金属的化学性质,酸的化学性质,原子的有关数量计算,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:(1)根据影响化学反应速率的因素回答,固体表面积越大,反应速率越大;
(2)根据化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,来判断可能的组成;
(3)根据书写方程式原则写出方程式,根据反应物与生成物种类判断反应类型;
(4)根据生成物中只有硫酸锌分析;
(5)根据从溶液中制得干燥纯净的固体一般有蒸发、结晶、过滤后洗涤并干燥等操作来回答;
(6)利用化学式的计算来分析.
(2)根据化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,来判断可能的组成;
(3)根据书写方程式原则写出方程式,根据反应物与生成物种类判断反应类型;
(4)根据生成物中只有硫酸锌分析;
(5)根据从溶液中制得干燥纯净的固体一般有蒸发、结晶、过滤后洗涤并干燥等操作来回答;
(6)利用化学式的计算来分析.
解答:解:(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分;
(2)相对分子质量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH),故铁原子、氧原子、氢原子个数比为1:2:1;
(3)氢氧化锌与硫酸反应生成硫酸锌和水,化学方程式为Zn(OH)2+H2SO4=ZnSO4+2H2O,此反应是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
(4)由于加入的硫酸是过量的,要得到纯净的硫酸锌溶液须除去过量硫酸,因此加入锌粉的目的是除去剩余的硫酸;
(5)滤液3是硫酸锌溶液,从溶液中得到溶质可采用蒸发结晶,然后干燥的方法;
(6)氢氧化锌中锌元素质量与碳酸锌中锌元素质量相等,故碳酸锌中锌元素质量为m2,根据碳酸锌的化学式ZnCO3可求出碳酸锌质量为
=
,菱锌矿粉的质量为m1,故菱锌矿粉中碳酸锌的质量分数最小为
×100%=
×100%
故答案为:
(1)菱锌矿粉与盐酸充分反应;
(2)1:2:1;
(3)Zn(OH)2+H2SO4=ZnSO4+2H2O;复分解反应;
(4)除去剩余的硫酸;
(5)蒸发或蒸发结晶;
(6)
或
.
(2)相对分子质量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH),故铁原子、氧原子、氢原子个数比为1:2:1;
(3)氢氧化锌与硫酸反应生成硫酸锌和水,化学方程式为Zn(OH)2+H2SO4=ZnSO4+2H2O,此反应是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;
(4)由于加入的硫酸是过量的,要得到纯净的硫酸锌溶液须除去过量硫酸,因此加入锌粉的目的是除去剩余的硫酸;
(5)滤液3是硫酸锌溶液,从溶液中得到溶质可采用蒸发结晶,然后干燥的方法;
(6)氢氧化锌中锌元素质量与碳酸锌中锌元素质量相等,故碳酸锌中锌元素质量为m2,根据碳酸锌的化学式ZnCO3可求出碳酸锌质量为
| m2 | ||
|
| 125m2 |
| 65 |
| 125m2 |
| 65m1 |
| 25m2 |
| 13m1 |
故答案为:
(1)菱锌矿粉与盐酸充分反应;
(2)1:2:1;
(3)Zn(OH)2+H2SO4=ZnSO4+2H2O;复分解反应;
(4)除去剩余的硫酸;
(5)蒸发或蒸发结晶;
(6)
| 25m2 |
| 13m1 |
| 125m2 |
| 65m1 |
点评:本题是流行的化工工艺流程题,主要依据流程图中涉及的化学知识、化学原理来设计问题.能够将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
下列物质在空气中放置一段时间后,易发生变质的是( )
| A、浓硫酸 | B、碳酸钙 |
| C、固体氢氧化钠 | D、食盐 |

 如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂.为了确定盐酸与氢氧化钠是否恰好完全反应,成员甲从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.他们依据所学的知识,对此展开探究:
如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂.为了确定盐酸与氢氧化钠是否恰好完全反应,成员甲从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.他们依据所学的知识,对此展开探究: