题目内容
小明同学为了测定市面销售的某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中分别加入11.0g样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体.
实验所得数据见表,请你分析并进行有关计算:
(1)白色固体是 (填化学式)
(2)样品中碳酸钠的质量是 g(结果精确到0.1%)
(3)氯化钙溶液中溶质质量分数是多少?(结果精确到0.1%)
实验所得数据见表,请你分析并进行有关计算:
| 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
| 加入氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
| 白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
(2)样品中碳酸钠的质量是
(3)氯化钙溶液中溶质质量分数是多少?(结果精确到0.1%)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠解答;
(2)分析表格中的数据可以知道11.0g样品最多生成10.0g沉淀,可以据此结合碳酸钠和氯化钙反应的化学方程式进而求算出碳酸钠的质量;
(3)烧杯1中沉淀的质量求出氯化钙的质量,利用溶质质量分数计算即可.
(2)分析表格中的数据可以知道11.0g样品最多生成10.0g沉淀,可以据此结合碳酸钠和氯化钙反应的化学方程式进而求算出碳酸钠的质量;
(3)烧杯1中沉淀的质量求出氯化钙的质量,利用溶质质量分数计算即可.
解答:解:
(1)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,故白色固体是碳酸钙;
(2)由实验数据可知,11.0g样品中的碳酸钠与氯化钙溶液充分反应最多生成10.0g碳酸钙.
设要生成10.0g碳酸钙需要碳酸钠的质量为
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.0g
=
x=10.6g
(3)由实验数据可知,烧杯1中氯化钙溶液完全反应完,生成5.0g碳酸钙.
设氯化钙溶液中溶质质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100
y 5.0g
=
解得x=5.55g
氯化钙溶液中溶质质量分数为:
×100%=10%
答案:
(1)CaCO3
(2)10.6
(3)氯化钙溶液中溶质质量分数是10%.
(1)碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,故白色固体是碳酸钙;
(2)由实验数据可知,11.0g样品中的碳酸钠与氯化钙溶液充分反应最多生成10.0g碳酸钙.
设要生成10.0g碳酸钙需要碳酸钠的质量为
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10.0g
| 106 |
| x |
| 100 |
| 10g |
x=10.6g
(3)由实验数据可知,烧杯1中氯化钙溶液完全反应完,生成5.0g碳酸钙.
设氯化钙溶液中溶质质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100
y 5.0g
| 111 |
| y |
| 100 |
| 5g |
解得x=5.55g
氯化钙溶液中溶质质量分数为:
| 5.55g |
| 55.5g |
答案:
(1)CaCO3
(2)10.6
(3)氯化钙溶液中溶质质量分数是10%.
点评:解答这类题目时,首先,要熟记和理解有关含杂质物质的化学反应的有关计算的方法、步骤和格式等相关知识;然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能进行分析计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
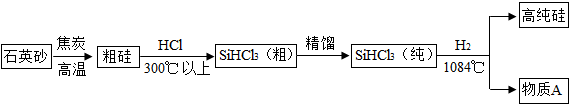
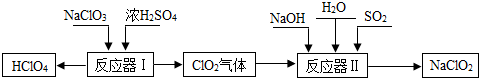
 如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂.为了确定盐酸与氢氧化钠是否恰好完全反应,成员甲从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.他们依据所学的知识,对此展开探究:
如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂.为了确定盐酸与氢氧化钠是否恰好完全反应,成员甲从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.他们依据所学的知识,对此展开探究:
 组成相似的盐具有一些相似的化学性质.
组成相似的盐具有一些相似的化学性质. :
: :
: :
: