题目内容
18.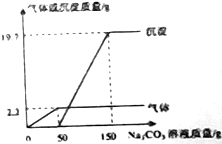 在实验课上,同学们用Ba(OH)2和稀盐酸做中和反应的实验探究,小亮取反应后的溶液105.9g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸溶液与生成沉淀的气体的质量关系如图所示.
在实验课上,同学们用Ba(OH)2和稀盐酸做中和反应的实验探究,小亮取反应后的溶液105.9g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸溶液与生成沉淀的气体的质量关系如图所示.(1)小亮所取反应后的溶液中的溶质有HCl和BaCl2
(2)滴入碳酸钠溶液后,生成的气体是CO2,沉淀是BaCO3(以上填化学式)
(3)当加入150g碳酸钠溶液时,所得溶液中溶质的质量为17.55g.
(4)请计算加入的碳酸钠溶液中碳酸钠的质量分数.(写出计算过程)
分析 (1)Ba(OH)2和稀盐酸反应生成氯化钡和水,根据当加入碳酸钠溶液时,先生成气体,而后有沉淀分析;
(2)根据碳酸钠与盐酸和氯化钡反应分析;
(3)根据二氧化碳气体质量和碳酸钡沉淀质量结合相应的化学方程式求解氯化钠质量.
(4)根据二氧化碳气体质量和碳酸钡沉淀质量结合相应的化学方程式求解碳酸钠质量,进而计算碳酸钠的质量分数.
解答 解:(1)Ba(OH)2和稀盐酸反应生成氯化钡和水,当加入碳酸钠溶液时,先生成气体,而后有沉淀,说明碳酸钠先与盐酸反应生成氯化钠、水和二氧化碳,而后碳酸钠与氯化钡反应生成碳酸钙和氯化钠,所以小亮所取反应后的溶液中的溶质有HCl和BaCl2
(2)滴入碳酸钠溶液后,碳酸钠先与盐酸反应生成氯化钠、水和二氧化碳,而后碳酸钠与氯化钡反应生成碳酸钙和氯化钠;
(3)由图可知生成二氧化碳的质量为2.2g;碳酸钡质量为19.7g
设与盐酸反应的碳酸钠质量为x,生成氯化钠质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑.
106 117 44
x y 2.2g
$\frac{106}{x}$=$\frac{117}{y}$=$\frac{44}{2.2g}$
x=5.3g,y=5.85g
设与氯化钡反应的碳酸钠质量为w,生成氯化钠质量为n
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197 117
w 19.7g n
$\frac{106}{w}$=$\frac{197}{19.7g}$=$\frac{117}{n}$
w=10.6g,n=11.7g
当加入150g碳酸钠溶液时,所得溶液中溶质的质量为5.85g+11.7g=17.55g;
(4)碳酸钠溶液中碳酸钠的质量分数为$\frac{5.3g+10.6g}{150g}$×100%=10.6%
故答案为:(1)HCl和BaCl2
(2)CO2;BaCO3;(3)17.55;
(4)10.6%
点评 要明确该题中发生反应的过程,理清思路是解决该题的关键,有一定难度.

| A. | NaCl CuSO4 NaNO3 | B. | NaCl K2SO4 NaOH | ||
| C. | HCl NaOH CaCl2 | D. | K2CO3 KNO3 BaCl2 |
| A. | 丁二酮属于有机高分子化合物 | |
| B. | 丁二酮中含有氧分子 | |
| C. | 丁二酮是由4个碳原子,6个氢原子,2个氧原子构成的 | |
| D. | 丁二酮中氧元素的质量分数为37.21% |
| A. |  滴加液体 | B. |  读取液体体积 | C. |  取用大理石 | D. |  点燃酒精灯 |

