题目内容
7.某化学兴趣小组为检查石灰石样品中碳酸钙的纯度,设计如下实验:①用天平称量12.0g石灰石样品放入小烧杯中;②取35.0mL稀盐酸(溶液密度为1g/mL);③倒入步骤1的小烧杯中,待充分反应(杂质不参加反应);④用pH试纸测得反应后溶液pH值为2;⑤操作X;⑥称量剩余固体物质质量为2.0g.
请回答以下问题:
(1)步骤②中取35.0mL稀盐酸所用的仪器有量筒、胶头滴管.
(2)步骤④的目的是测试稀盐酸是否反应完全;
写出测定溶液PH的操作步骤:撕一小段pH试纸置于表面皿中,用玻璃棒蘸取试液滴在pH试纸上,再与标准比色卡对照读出pH值
(3)步骤⑤的操作X名称有蒸发、干燥和洗涤.
(4)碳酸钙的纯度为83.3%.
(5)步骤③所得溶液中CaCl2的质量分数(写计算过程)(精确到0.1%).
分析 (1)考虑量取一定量液体的方法和使用仪器;
(2)用pH试纸测得反应后溶液,以判断稀盐酸是否反应完全;根据pH试纸的使用方法进行分析.
(3)为了准确知道剩余固体物质质量,推测步骤⑤的操作;
(4)根据剩余固体物质质量,计算石灰石样品中碳酸钙的质量分数;
(5)利用化学方程式进行计算,求得所得溶液中CaCl2的质量分数.
解答 解:
(1)步骤②中取35.0ml稀盐酸所用的仪器有量筒、胶头滴管.
(2)步骤④用pH试纸测得反应后溶液的目的是测试稀盐酸是否反应完全.用pH试纸测定溶液的pH时的正确做法:撕一小段pH试纸置于表面皿中,用玻璃棒蘸取试液滴在pH试纸上,再与标准比色卡对照读出pH值.
(3)为了准确知道剩余固体物质质量,则步骤⑤的操作X名称有蒸发、干燥和 洗涤.
(4)石灰石样品中碳酸钙的质量分数为量$\frac{12.0g-2.0g}{12.0g}$×100%≈83.3%.
(5)解:碳酸钙的质量为12.0g-2.0g=10.0g
设步骤③所得溶液中CaCl2的质量为x,生成二氧化碳的质量为y.
CaCO3+2HCl=CaCl2+H20+CO2↑
100 111 44
10.0g x y
则$\frac{100}{10.0g}$=$\frac{111}{x}$,解得x=11.1g
则$\frac{100}{10.0g}$=$\frac{44}{y}$,解得y=4.4g.
步骤③所得溶液中CaCl2的质量分数为:$\frac{11.1g}{10.0g+35.0g-4.4g}$×100%≈27.3%
故答案为:
(1)量筒、胶头滴管.(2)测试稀盐酸是否反应完全;撕一小段pH试纸置于表面皿中,用玻璃棒蘸取试液滴在pH试纸上,再与标准比色卡对照读出pH值.
(3)蒸发、干燥和 洗涤.(4)83.3%.(5)27.3%
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,注意利用化学方程式进行计算的方法步骤;增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 蜡烛燃烧后的余烬所剩无尽 | |
| B. | 取20克石灰石于烧杯中再向其中加入50克稀盐酸恰好完全反应,反应后烧杯中物质总质量为66.7克 | |
| C. | 4g食盐晶体溶于96g水中,溶液的质量为100g | |
| D. | 10g镁带在空气中燃烧后,生成物的质量为18g比镁带质量增加了 |
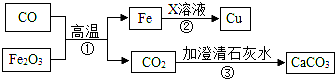
| A. | 反应①中CO发生氧化反应 | |
| B. | 反应②的化学方程式是:Fe+Cu(OH)2=Cu+Fe(OH)2 | |
| C. | X溶液可能是硫酸铜溶液 | |
| D. | 反应③可以检验二氧化碳气体 |
| A. | 10.0g | B. | 18.7g | C. | 20.0g | D. | 16.7g |
 在实验课上,同学们用Ba(OH)2和稀盐酸做中和反应的实验探究,小亮取反应后的溶液105.9g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸溶液与生成沉淀的气体的质量关系如图所示.
在实验课上,同学们用Ba(OH)2和稀盐酸做中和反应的实验探究,小亮取反应后的溶液105.9g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸溶液与生成沉淀的气体的质量关系如图所示. 请用化学用语填空:
请用化学用语填空:
 钠是一种非常活泼的金属.它可以和冷水直接反应生成氢气,(钠+水→氢氧化钠+氢气,)但是它与煤油不会发生反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中,如图所示,可以看到钠浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和
钠是一种非常活泼的金属.它可以和冷水直接反应生成氢气,(钠+水→氢氧化钠+氢气,)但是它与煤油不会发生反应.把一小块银白色的金属钠投入盛有蒸馏水的烧杯中,如图所示,可以看到钠浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧.如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和