题目内容
3.请从C、H、O、S、Cl、Na、Fe等7种元素中选择恰当的元素,用离子符号、化学式或者化学方程式按照下列要求填空:(1)硫酸溶液中的阴离子是SO42-;
(2)氯化铁溶液中的阳离子是Fe3+
(3)写出一个能发生中和反应的化学方程式:HCl+NaOH=NaCl+H2O(合理即可).
分析 (1)硫酸溶液中的阴离子硫酸根离子.
(2)氯化铁中的阳离子是铁离子.
(3)中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水,据此进行分析解答.
解答 解:(1)硫酸溶液中的阴离子硫酸根离子,其离子符号为:SO42-.
(2)氯化铁中的阳离子是铁离子,其离子符号为:Fe3+.
(3)由提供的元素组成的物质,盐酸与氢氧化钠反应生成氯化钠和水,属于中和反应,反应的化学方程式为:HCl+NaOH=NaCl+H2O(合理即可).
故答案为:(1)SO42-;(2)Fe3+;(3)HCl+NaOH=NaCl+H2O(合理即可)
点评 本题难度不大,掌握常见化学用语(化学方程式、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
13.下列书写符合要求的是( )
| A. | 氧离子:O-2 | B. | 2个氢原子:H2 | ||
| C. | 氢氧化镁的化学式:Mg(OH)2 | D. | 铁离子:Fe2+ |
8. 根据图中的信息判断,下列说法正确的是( )
根据图中的信息判断,下列说法正确的是( )
 根据图中的信息判断,下列说法正确的是( )
根据图中的信息判断,下列说法正确的是( )| A. | 氯原子的中子数是1 | B. | 氯原子核外有2个电子层 | ||
| C. | 当x=8时,该微粒是阳离子 | D. | 在化学变化中,氯原子易得到电子 |
15.下列叙述中,不符合质量守恒定律的是( )
| A. | 蜡烛燃烧后的余烬所剩无尽 | |
| B. | 取20克石灰石于烧杯中再向其中加入50克稀盐酸恰好完全反应,反应后烧杯中物质总质量为66.7克 | |
| C. | 4g食盐晶体溶于96g水中,溶液的质量为100g | |
| D. | 10g镁带在空气中燃烧后,生成物的质量为18g比镁带质量增加了 |
2.镁在氧气与氮气的混合气体中燃烧不仅生成氧化镁,还有少量的镁与氮气化合生成氮化镁.由此推知12.0g镁在氧气与氮气的混合气体中完全燃烧后所得的产物的质量可能是( )
| A. | 10.0g | B. | 18.7g | C. | 20.0g | D. | 16.7g |
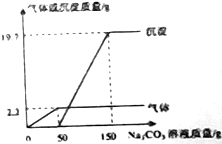 在实验课上,同学们用Ba(OH)2和稀盐酸做中和反应的实验探究,小亮取反应后的溶液105.9g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸溶液与生成沉淀的气体的质量关系如图所示.
在实验课上,同学们用Ba(OH)2和稀盐酸做中和反应的实验探究,小亮取反应后的溶液105.9g,滴入碳酸钠溶液,先后有气体和白色沉淀生成.加入碳酸溶液与生成沉淀的气体的质量关系如图所示.