题目内容
15.为了探究金属与酸反应的速率与哪些因素有关,小谷进行了以下实验探究:【实验方案】
| 实验步骤 | 现象 | 结论 |
| ①将足量铁粉与锌粉分别放入10%100mL稀硫酸中,观察现象 | 产生气泡速率:Fe<Zn | 反应速率与反应物的金属活动性强弱有关 |
| ②将等质量锌粉与锌片分别放入10%100mL稀硫酸中,观察现象 | 产生气泡速率:锌粉>锌片 | 反应速率与反应物的接触面积大小有关 |
【继续探究】小谷对锌粉一稀硫酸反应过程中速率的变化情况进行探究.在100mL稀硫酸中加入足量的锌粉,用下图中的一种装置收集并测量氢气的体积.记录的实验数据如下表:
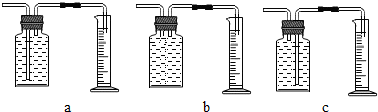
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)实验数据反应,锌与稀硫酸反应的速率是先逐渐加快,一定时间后反应速率逐渐减慢,其原因是随着反应的进行,硫酸的浓度变小,反应速率变慢;
(3)若反应太剧烈,操作难以控制,为了减缓反应速率但又不减少产生氢气的质量,可在硫酸溶液中加入适量的(多选)AB.
A.蒸馏水 B.Na2SO4溶液 C.Na2CO3 D.CuO.
分析 【实验方案】根据实验现象以及实验结论进行解答;
【讨论】(1)根据氢气的密度小于水的密度且难溶于水进行解答;
(2)根据随着反应的进行,硫酸的浓度变小,反应速率变慢进行解答;
(3)根据反应的快慢与反应物的浓度有关,且反应物的浓度越小,反应速率越慢进行解答.
解答 解:【实验方案】
| 实验步骤 | 现象 | 结论 |
| ①将足量铁粉与锌粉分别放入10%100mL稀硫酸中,观察现象 | 产生气泡速率:Fe<Zn | 反应速率与反应物的金属活动性强弱有关 |
| ②将等质量锌粉与锌片分别放入10%100mL稀硫酸中,观察现象 | 产生气泡速率:锌粉>锌片 | 反应速率与反应物的接触面积大小有关 |
(2)实验数据反应,锌与稀硫酸反应的速率是先逐渐加快,一定时间后反应速率逐渐减慢,其原因是:随着反应的进行,硫酸的浓度变小,反应速率变慢;
(3)根据反应的快慢与反应物的浓度有关,且反应物的浓度越小,反应速率越慢,所以为了减缓反应速率但又不减少产生氢气的质量,可在硫酸溶液中加入适量的蒸馏水和硫酸钠溶液,而碳酸钠和氧化铜都会硫酸反应,会使得生成的氢气减少.
故答案为:【实验方案】①金属活动性强弱;②锌粉>锌片;
【讨论】(1)c;根据进入量筒中水的体积,判断生成氢气的体积;
(2)随着反应的进行,硫酸的浓度变小,反应速率变慢;
(3)AB.
点评 本题通过对比实验结果的分析,找到事物的内在联系,考查了学生分析问题的能力,同时也是对影响反应速率因素这一知识点的重点考查.此题是对制氢气的探究,分析时采用控制变量的方法对问题进行分析是解决此类题常用的方式.

练习册系列答案
相关题目
13. 兴趣小组同学对“氢氧化钠溶液与硫酸混合是否发生发应”进行了如下探究:
兴趣小组同学对“氢氧化钠溶液与硫酸混合是否发生发应”进行了如下探究:
【提出问题】二者混合后是否发生了反应?
【猜想与假设】a、二者混合后发生了反应 b、二者混合后没有发生反应
【设计并实验】
【得出结论】(1)根据甲同学的实验现象说明二者混合后发生了反应,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O.
(2)乙同学的实验中通过溶液的颜色改变,说明溶液的酸碱性发生了改变,从而也证明了二者混合后发生了反应.
【思考与交流】
丙同学在绝热装置中,向分别盛有10mL10%氢氧化钠溶液加入不同体积某浓度的硫酸,充分混合后溶液的温度变化曲线如图(混合前硫酸和氢氧化钠溶液均为18℃)
(3)根据图示分析,硫酸和氢氧化钠的反应是放热(填“吸热”或“放热”)反应,加入硫酸10mL时,二者恰好完全反应.
[注意:若答对第(4)小题奖励4分,化学试卷总分不超过60分]
(4)除了上述一些方法外,请你再设计一个实验证明二者确实发生了反应.
 兴趣小组同学对“氢氧化钠溶液与硫酸混合是否发生发应”进行了如下探究:
兴趣小组同学对“氢氧化钠溶液与硫酸混合是否发生发应”进行了如下探究:【提出问题】二者混合后是否发生了反应?
【猜想与假设】a、二者混合后发生了反应 b、二者混合后没有发生反应
【设计并实验】
| 实验操作 | 实验现象 | |
| 甲同学 | 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入硫酸,不断振荡溶液,同时测定溶液的pH. | 溶液pH不断减小,最终小于7. |
| 乙同学 | 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞试液,然后再加入硫酸并不断搅拌. | 溶液由红色变为无色. |
(2)乙同学的实验中通过溶液的颜色改变,说明溶液的酸碱性发生了改变,从而也证明了二者混合后发生了反应.
【思考与交流】
丙同学在绝热装置中,向分别盛有10mL10%氢氧化钠溶液加入不同体积某浓度的硫酸,充分混合后溶液的温度变化曲线如图(混合前硫酸和氢氧化钠溶液均为18℃)
(3)根据图示分析,硫酸和氢氧化钠的反应是放热(填“吸热”或“放热”)反应,加入硫酸10mL时,二者恰好完全反应.
[注意:若答对第(4)小题奖励4分,化学试卷总分不超过60分]
(4)除了上述一些方法外,请你再设计一个实验证明二者确实发生了反应.
10.下列各组物质在某pH=2的无色溶液中,能大量共存的是( )
| A. | CuCl2和NaCl | B. | KNO3和Na2CO3 | C. | BaCl2和NaOH | D. | MgCl2和NaNO3 |
20.为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了如图所示实验.下列有关说法不正确的是( )
| 实验① | 实验② | 实验③ |
 |  |  |
| A. | 对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响 | |
| B. | 对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响 | |
| C. | 对比实验①和③,可研究温度对反应剧烈程度的影响 | |
| D. | 以上实验只能对比出浓度和温度对反应的影响,但还未能体现表面积对反应的影响 |
4.在超市货架上出售的“高锌高钙奶粉”中的锌、钙指的是( )
| A. | 金属锌、金属钙 | B. | 锌元素、钙元素 | C. | 锌原子、钙原子 | D. | 锌分子、钙分子 |
18.二氧化钛(TiO2)薄膜可制新型“纳米纸”,可用于检测食品中亚硝酸钠浓度的高低.TiO2中钛元素的化合价是( )
| A. | -2 | B. | +2 | C. | -4 | D. | +4 |
 我市某化学兴趣小组的同学用洁净的塑料瓶从河中取回一定量的水样,然后进行如下研究分析:
我市某化学兴趣小组的同学用洁净的塑料瓶从河中取回一定量的水样,然后进行如下研究分析: