题目内容
13. 兴趣小组同学对“氢氧化钠溶液与硫酸混合是否发生发应”进行了如下探究:
兴趣小组同学对“氢氧化钠溶液与硫酸混合是否发生发应”进行了如下探究:【提出问题】二者混合后是否发生了反应?
【猜想与假设】a、二者混合后发生了反应 b、二者混合后没有发生反应
【设计并实验】
| 实验操作 | 实验现象 | |
| 甲同学 | 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入硫酸,不断振荡溶液,同时测定溶液的pH. | 溶液pH不断减小,最终小于7. |
| 乙同学 | 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞试液,然后再加入硫酸并不断搅拌. | 溶液由红色变为无色. |
(2)乙同学的实验中通过溶液的颜色改变,说明溶液的酸碱性发生了改变,从而也证明了二者混合后发生了反应.
【思考与交流】
丙同学在绝热装置中,向分别盛有10mL10%氢氧化钠溶液加入不同体积某浓度的硫酸,充分混合后溶液的温度变化曲线如图(混合前硫酸和氢氧化钠溶液均为18℃)
(3)根据图示分析,硫酸和氢氧化钠的反应是放热(填“吸热”或“放热”)反应,加入硫酸10mL时,二者恰好完全反应.
[注意:若答对第(4)小题奖励4分,化学试卷总分不超过60分]
(4)除了上述一些方法外,请你再设计一个实验证明二者确实发生了反应.
分析 【设计并实验】根据溶液酸碱性与无色酚酞试液的变色情况分析;
(1)根据氢氧化钠与稀硫酸反应写化学方程式;
(3)根据图示判断;
(4)根据氢氧化钠与稀硫酸反应后氢氧化钠会消失,来设计对比实验;
解答 解:【设计并实验】无色酚酞试液遇碱变红,遇中性或酸性物质不变色;
(1)氢氧化钠与稀硫酸反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O;
(3)根据图示分析,硫酸和氢氧化钠的反应是放热反应,当加入稀硫酸10mL时,二者恰好完全反应.
(4)实验方案为:取两支试管各加入10mL10%的氢氧化钠溶液,分别向两只试管中加入10mL蒸馏水和上述浓度的稀硫酸,再分别加入硫酸铜溶液,前者有蓝色沉淀产生,后者无明显现象,即证明二者混合发生了反应.
故答案为:
【设计并实验】红;无
(1)2NaOH+H2SO4═Na2SO4+2H2O;
(3)放热;10;
(4)取两支试管各加入10mL10%的氢氧化钠溶液,分别向两只试管中加入10mL蒸馏水和上述浓度的稀硫酸,再分别加入硫酸铜溶液,前者有蓝色沉淀产生,后者无明显现象,即证明二者混合发生了反应.
点评 本题较综合的考查了学生对酸和碱化学知识的掌握和应用,掌握并理解知识才能熟练地利用知识设计实验、分析解决相关问题.

练习册系列答案
相关题目
3.下列化学方程式的书写和相应的基本反应类型均正确的是( )
| A. | 用稀硫酸除去铁锈:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O 复分解反应 | |
| B. | 电解水时,两极均产生气泡:2H2O $\frac{\underline{\;电解\;}}{\;}$2H2+O2↑ 分解反应 | |
| C. | 实验室制取二氧化碳:CaCO3+HCl═CaCl2+H2O+CO2↑ 中和反应 | |
| D. | 用磁铁矿炼铁:4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 置换反应 |
4.五月初五,粽叶飘香,你能闻到香味是因为( )
| A. | 分子的质量小 | B. | 分子之间有间隙 | C. | 分子的体积小 | D. | 分子在不断运动 |
18.溶液是生产生活中常见的物质,依据相关信息回答问题:
资料:硝酸钾的溶解度数据(部分数据已做取整数处理)如表所示:
(1)硝酸钾是一种常用的复合肥,能为作物补充N、K(填元素符号).
(2)A、B、C、D四个烧杯中分别盛有100g水,在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示.

①D(填字母序号)中盛的是不饱和溶液.
②烧杯A、B、C中溶液的溶质质量分数大小关系为a
a.三者一样大 b.A最大,C最小 c.无法判断
(3)若将(2)中烧杯C的液体倒入烧杯A中,通过调节温度,可使得混合后溶液恰好饱和且不存在KNO3固体.则混合液的温度应该调整至接近50℃.
资料:硝酸钾的溶解度数据(部分数据已做取整数处理)如表所示:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 溶解度/g | 21 | 32 | 46 | 64 | 86 | 110 | 138 |
(2)A、B、C、D四个烧杯中分别盛有100g水,在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示.

①D(填字母序号)中盛的是不饱和溶液.
②烧杯A、B、C中溶液的溶质质量分数大小关系为a
a.三者一样大 b.A最大,C最小 c.无法判断
(3)若将(2)中烧杯C的液体倒入烧杯A中,通过调节温度,可使得混合后溶液恰好饱和且不存在KNO3固体.则混合液的温度应该调整至接近50℃.
15.为了探究金属与酸反应的速率与哪些因素有关,小谷进行了以下实验探究:
【实验方案】
【发现问题】在同一反应中速率也不一样.
【继续探究】小谷对锌粉一稀硫酸反应过程中速率的变化情况进行探究.在100mL稀硫酸中加入足量的锌粉,用下图中的一种装置收集并测量氢气的体积.记录的实验数据如下表:
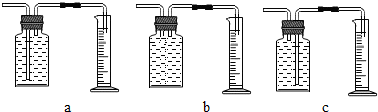
【讨论】(1)实验中测定反应产生氢气的体积可选用的装置是c(填序号),其中量筒的作用时根据进入量筒中水的体积,判断生成氢气的体积;
(2)实验数据反应,锌与稀硫酸反应的速率是先逐渐加快,一定时间后反应速率逐渐减慢,其原因是随着反应的进行,硫酸的浓度变小,反应速率变慢;
(3)若反应太剧烈,操作难以控制,为了减缓反应速率但又不减少产生氢气的质量,可在硫酸溶液中加入适量的(多选)AB.
A.蒸馏水 B.Na2SO4溶液 C.Na2CO3 D.CuO.
【实验方案】
| 实验步骤 | 现象 | 结论 |
| ①将足量铁粉与锌粉分别放入10%100mL稀硫酸中,观察现象 | 产生气泡速率:Fe<Zn | 反应速率与反应物的金属活动性强弱有关 |
| ②将等质量锌粉与锌片分别放入10%100mL稀硫酸中,观察现象 | 产生气泡速率:锌粉>锌片 | 反应速率与反应物的接触面积大小有关 |
【继续探究】小谷对锌粉一稀硫酸反应过程中速率的变化情况进行探究.在100mL稀硫酸中加入足量的锌粉,用下图中的一种装置收集并测量氢气的体积.记录的实验数据如下表:

| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)实验数据反应,锌与稀硫酸反应的速率是先逐渐加快,一定时间后反应速率逐渐减慢,其原因是随着反应的进行,硫酸的浓度变小,反应速率变慢;
(3)若反应太剧烈,操作难以控制,为了减缓反应速率但又不减少产生氢气的质量,可在硫酸溶液中加入适量的(多选)AB.
A.蒸馏水 B.Na2SO4溶液 C.Na2CO3 D.CuO.
16.正确的设计实验方案时科学探究的重要环节.认真细致的观察和分析实验现象是获得化学知识的重要途径,以下化学实验设计能达到实验目的是( )
| A. |  验证质量守恒定律 | B. |  测定空气中的氧气含量 | ||
| C. |  证明CO2密度比空气大 | D. |  证明CO2能与水反应 |