题目内容
12. 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,某兴趣小组对它开展了以下研究.
硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,某兴趣小组对它开展了以下研究.(1)硝酸铜的制备研究
该小组同学查阅资料发现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O
甲同学认为三种方案的反应都可以在铁制容器中进行,乙同学认为不可行(填“可行”“不
可行”),理由是(用一个化学方程式表示)Fe+Cu(NO3)2═Cu+Fe(NO3)2.从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法③,理由是①②产生污染空气的有害气体,③中反应过程没有有毒气体生成,不污染环境,硝酸利用率高.
(2)硝酸铜的性质研究
硝酸铜为蓝色固体,溶于水可得蓝色溶液.该小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4═CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解,过 滤,向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤II:在如图的试管和集气瓶之间连上此图所示的装置,重新进行加热硝酸铜的实验  | 集气瓶中气体为无色,带火星的木条复燃 带火星的木条复燃 | 硝酸铜分解生成了氧气 |
【获得结论】根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
该小组同学取10g的硝酸铜加热一段时间后,测得剩余固体的质量为4.6g,则硝酸铜的分解率为9.2%?(分解率为已分解的硝酸铜占原硝酸铜的质量分数,写出计算过程)
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
分析 (1)根据金属活动性顺序,铁比铜活泼解答;根据反应方程式判断是否有污染环境的物质生成解答.
(2)【猜想假设】根据质量守恒定律和资料推测Cu(NO3)2受热分解除了生成NO2;
【进行实验】因为氧化铜难溶于水,可以通过溶解,过滤,洗涤的方式与可溶性物质进行分离.而后加热稀硫酸,稀硫酸与氧化铜反应生成硫酸铜,得到蓝色溶液;NO2气体易液化,通过含冰制冷剂能将其液化;从而与其他气体分离,剩余的气体仍可以使带火星木条复燃,说明Cu(NO3)2受热分解还生成了氧气;
【获得结论】根据实验结果,Cu(NO3)2受热分解生成CuO、NO2、O2,故可书写化学方程式;
【反思与评价】通过化学反应,硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
解答 解:
(1)根据金属活动性顺序,铁比铜活泼,三种方案的反应不能可以在铁制容器中进行,因为:Fe+Cu(NO 3 )2═Cu+Fe(NO3)2;
从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法③;理由是方案①②产生污染空气的有害气体;③中反应过程没有有毒气体生成,不污染环境,硝酸利用率高;
(2)【猜想假设】根据“加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃”、“②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.③NO2有助燃性,能使带火星的木条复燃”和质量守恒定律,推测Cu(NO3)2受热分解除了生成NO2;
【进行实验】因为氧化铜难溶于水,可以通过溶解,过滤,洗涤的方式与可溶性物质进行分离.而后加热稀硫酸,稀硫酸与氧化铜反应生成硫酸铜,得到蓝色溶液,其化学方程式为CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O;步骤II:在如图的试管和集气瓶之间连上此图所示的装置,重新进行加热硝酸铜的实验,集气瓶中气体为无色,带火星的木条复燃,硝酸铜分解生成了氧气;
步骤II是同学们查阅了新的资料后设计完成的.该资料是关于NO2的沸点(或低温下NO2能否反应生成液态或固态物质);
【获得结论】根据实验结果,Cu(NO3)2受热分解生成CuO、NO2、O2,故可书写化学方程式2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑;
设反应的硝酸铜的质量为x
2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑ 固体减重
376 160 216
X 10g-4.6g=5.4g
$\frac{376}{X}=\frac{216}{5.4g}$
X=9.2g
则硝酸铜的分解率为:$\frac{9.2g}{10g}×$100%=92%
【反思与评价】通过化学反应,硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性;
故答案为:
(1)不可行;Fe+Cu(NO 3 )2═Cu+Fe(NO3)2; 方案①②产生污染空气的有害气体;③中反应过程没有有毒气体生成,不污染环境,硝酸利用率高;
(2)【猜想假设】NO2;
【进行实验】】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解,过 滤,向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤II:在如图的试管和集气瓶之间连上此图所示的装置,重新进行加热硝酸铜的实验  | 集气瓶中气体为无色,带火星的木条复燃 带火星的木条复燃 | 硝酸铜分解生成了氧气 |
【获得结论】2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑;9.2%;
【分析及反思】硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
点评 本题考查了化学方程式的书写,又考查了同学们实验方案的设计,难度较大,注意根据实验目的设计实验方案.

 如是a、b、c三种物质的溶解度曲线.下列分析不正确的是( )
如是a、b、c三种物质的溶解度曲线.下列分析不正确的是( )| A. | 要配制相同质量分数的a、c两种物质的饱和溶液,应该将温度控制在t1℃ | |
| B. | 将t2℃时a、b、c三种饱和溶液分别降温至t1℃,所得溶液的溶质质量分数最大的是b溶液 | |
| C. | 将c物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法 | |
| D. | t2℃时,将30ɡ a物质加入50ɡ水中不断搅拌,形成的溶液中溶质质量分数是37.5% |
 下列各组物质中,能相互反应且反应前后溶液总质量随时间变化符合如图所示的是( )
下列各组物质中,能相互反应且反应前后溶液总质量随时间变化符合如图所示的是( )| A. | 铁和硝酸银溶液 | B. | 硫酸和烧碱溶液 | ||
| C. | 氧化铜和盐酸 | D. | 硝酸钾溶液和稀硫酸 |
 在生活和化学实验中,人们经常用到各种除湿剂(即干燥剂).
在生活和化学实验中,人们经常用到各种除湿剂(即干燥剂).
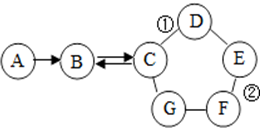 如图所示的是物质A~G相互间的关系(“->”表示物质间存在的转化关系,“-”表示两端的物质能发生化学反应).A、F都是单质;F是使用最多的金属材料;B是导致温室效应的主要气体;C在工业上广泛用于玻璃、造纸、纺织和洗涤剂的生产等;D可用来改良酸性土壤;E是一种蓝色的硫酸盐溶液.请回答:
如图所示的是物质A~G相互间的关系(“->”表示物质间存在的转化关系,“-”表示两端的物质能发生化学反应).A、F都是单质;F是使用最多的金属材料;B是导致温室效应的主要气体;C在工业上广泛用于玻璃、造纸、纺织和洗涤剂的生产等;D可用来改良酸性土壤;E是一种蓝色的硫酸盐溶液.请回答: A、B、C是初中化学常见的物质,相互关系如图所示,图中“--”表示物质间可以相互反应.其中A、B、C是酸碱盐中的一种,A能与地壳中含量第二的金属元素组成的单质反应且只含两种元素,B是一种钠盐.请回答下列问题:
A、B、C是初中化学常见的物质,相互关系如图所示,图中“--”表示物质间可以相互反应.其中A、B、C是酸碱盐中的一种,A能与地壳中含量第二的金属元素组成的单质反应且只含两种元素,B是一种钠盐.请回答下列问题:
