题目内容
17.有一包白色固体粉末,可能含有CuSO4、Na2SO4、(NH4)2CO3、BaCl2、NH4Cl、KCl中的一种或几种.现做如图实验:
根据上述实验现象判断:
(1)白色固体中一定不含CuSO4、(NH4)2CO3,一定含有Na2SO4、BaCl2、NH4Cl,可能含有KCl.
(2)写出①中化学反应方程式:BaCl2+Na2SO4═BaSO4↓+2NaCl.
(3)写出②中化学反应方程式:NH4Cl+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+H2O+NH3↑.
分析 根据题目给出的流程图和信息:由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定有硫酸钡,原物质中一定有了氯化钡和硫酸钠,就一定不能再有碳酸铵了,因为碳酸钡溶于盐酸,此白色固体是硫酸钡;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,据此分析.
解答 解:(1)由步骤①可知,白色固体中一定没有硫酸铜,因为硫酸铜溶于水呈蓝色;过滤得到的白色固体加入足量的盐酸不溶解,因此白色固体中一定有硫酸钡,原物质中一定有了氯化钡和硫酸钠,就一定不能再有碳酸铵了,因为碳酸钡溶于盐酸,此白色固体是硫酸钡,说明原混合物中一定有Na2SO4、BaCl2;由步骤②可知,加入氢氧化钠溶液加热,产生了能使湿润的红色石蕊试纸变蓝的气体,此气体是氨气,因此原白色固体中一定含有氯化铵;KCl可能有也可能没有;
(2)反应①是硫酸钠和氯化钡反应生成硫酸钡白色沉淀和氯化钠,化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl;
(3)反应②是氯化铵和氢氧化钠反应产生氯化钠、氨气和水,化学方程式为:NH4Cl+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+H2O+NH3↑.
故答案为:(1)CuSO4、(NH4)2CO3;Na2SO4、BaCl2、NH4Cl;KCl;
(2)Na2SO4+BaCl2═BaSO4↓+2NaCl;
(3)NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.

【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下,请你补充猜想四:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH 猜想四:Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是四,理由是氢氧化钠和稀硫酸不能共存
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有氢氧化钠.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  | 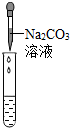 | 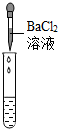 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
①实验操作中的错误是把pH试纸浸入溶液中.
②实验方案中也有一个是错误的,错误的原因是硫酸钠也能够和氯化钡反应生成硫酸钡沉淀,不能证明一定有硫酸存在.
 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,某兴趣小组对它开展了以下研究.
硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,某兴趣小组对它开展了以下研究.(1)硝酸铜的制备研究
该小组同学查阅资料发现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O
甲同学认为三种方案的反应都可以在铁制容器中进行,乙同学认为不可行(填“可行”“不
可行”),理由是(用一个化学方程式表示)Fe+Cu(NO3)2═Cu+Fe(NO3)2.从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法③,理由是①②产生污染空气的有害气体,③中反应过程没有有毒气体生成,不污染环境,硝酸利用率高.
(2)硝酸铜的性质研究
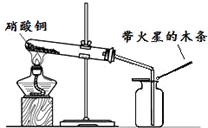
硝酸铜为蓝色固体,溶于水可得蓝色溶液.该小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4═CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解,过 滤,向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤II:在如图的试管和集气瓶之间连上此图所示的装置,重新进行加热硝酸铜的实验 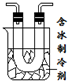 | 集气瓶中气体为无色,带火星的木条复燃 带火星的木条复燃 | 硝酸铜分解生成了氧气 |
【获得结论】根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
该小组同学取10g的硝酸铜加热一段时间后,测得剩余固体的质量为4.6g,则硝酸铜的分解率为9.2%?(分解率为已分解的硝酸铜占原硝酸铜的质量分数,写出计算过程)
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
 A、B、C、D、E是初中化学中常见的物质,其转化关系如图所示,请依据转化关系图,写出符合要求的一组答案.
A、B、C、D、E是初中化学中常见的物质,其转化关系如图所示,请依据转化关系图,写出符合要求的一组答案. A、B、C、D都是初中化学中常见物质,它们间关系如图所示(反应条件已省略).
A、B、C、D都是初中化学中常见物质,它们间关系如图所示(反应条件已省略). 如图A、B、C为三种物质的溶解度曲线,据图回答:
如图A、B、C为三种物质的溶解度曲线,据图回答: