题目内容
7. A、B、C是初中化学常见的物质,相互关系如图所示,图中“--”表示物质间可以相互反应.其中A、B、C是酸碱盐中的一种,A能与地壳中含量第二的金属元素组成的单质反应且只含两种元素,B是一种钠盐.请回答下列问题:
A、B、C是初中化学常见的物质,相互关系如图所示,图中“--”表示物质间可以相互反应.其中A、B、C是酸碱盐中的一种,A能与地壳中含量第二的金属元素组成的单质反应且只含两种元素,B是一种钠盐.请回答下列问题:(1)物质A是HCl(写化学式,下同),物质C是Ca(OH)2.
(2)物质B俗称纯碱(或苏打),物质C的用途:作建筑材料(或改良酸性土壤或配制农药波尔多液等)(写一种).
(3)写出物质B与C反应的化学反应方程式Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,该反应的基本类型是复分解反应.
分析 A、B、C是初中化学常见的物质,“--”表示物质间可以相互反应,A、B、C是酸碱盐中的一种,A能与地壳中含量第二的金属元素组成的单质反应,地壳中含量第二的金属元素组成的单质是铁,且只含两种元素,结合盐酸中含有2种元素,铁能与盐酸反应,则A为盐酸;B是一种钠盐,A能与B反应,盐酸能与碳酸钠反应,则B为碳酸钠;碳酸钠、盐酸均能与氢氧化钙反应,则C为氢氧化钙;据此进行分析解答.
解答 解:A、B、C是初中化学常见的物质,“--”表示物质间可以相互反应,A、B、C是酸碱盐中的一种,A能与地壳中含量第二的金属元素组成的单质反应,地壳中含量第二的金属元素组成的单质是铁,且只含两种元素,结合盐酸中含有2种元素,铁能与盐酸反应,则A为盐酸;B是一种钠盐,A能与B反应,盐酸能与碳酸钠反应,则B为碳酸钠;碳酸钠、盐酸均能与氢氧化钙反应,则C为氢氧化钙.
(1)物质A是盐酸,C是氢氧化钙,其化学式分别是HCl、Ca(OH)2.
(2)物质B是碳酸钠,其俗称为纯碱或苏打;物质C为氢氧化钙,可用作建筑材料(或改良酸性土壤或配制农药波尔多液等).
(3)物质B与C反应,即碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应.
故答案为:(1)HCl;Ca(OH)2;(2)纯碱(或苏打);做建筑材料(或改良酸性土壤或配制农药波尔多液);(3)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;复分解反应.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案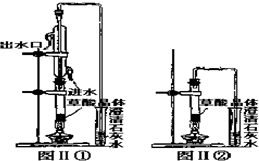 小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.
小丽喜食豆腐,今天,小丽让妈妈为她做菠菜炒豆腐,可小丽的妈妈却告诉她菠菜不能与豆腐同食.【提出问题】菠菜为什么不能与豆腐同食?
【查阅资料】草酸钙(CaC2O4)是不能被人体吸收的沉积物.豆腐中含有较多的钙盐 如硫酸钙(CaSO4)等,菠菜、洋葱、竹笋中含有丰富的草酸(H2C2O4)、草酸钠(Na2C2O4),豆腐和上述几种蔬菜混合食用,可能诱发“结石”症.
(1)由草酸的化学式可知草酸由C、H、O三种元素组成.
(2)草酸与硫酸钙反应的化学方程式为H2C2O4+CaSO4?CaC2O4↓+H2SO4,请写出草酸钠与硫酸钙反应的化学方程式:Na2C2O4+CaSO4═Na2SO4+CaC2O4↓.
【提出猜想】菠菜与豆腐同食可能会诱发“结石”症.
【设计实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①将菠菜在少量开水中煮沸2min~3min,取1mL~2mL滤液于试管中,丙滴加少量CaSO4或CaCl2溶液 | 产生白色沉淀 | 有草酸钙生成 |
| ②在步骤①的沉淀物中加入过量稀盐酸 | 沉淀部分溶解且产生气泡 | 被溶解的沉淀一定不是CaC2O4 |
| 实验步骤 | 实验现象 | 实验结论 |
| ③将步骤②产生的气体通入澄清的石灰水中 | 澄清的石灰水变浑浊 | 产生的气体是CO2步骤②被溶解的沉淀是碳酸钙 |
利用图Ⅱ①和图Ⅱ②加热草酸晶体,以验证草酸受热是否分解.连续加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清,其原因CaCO3+H2O+CO2═Ca(HCO3)2;图Ⅱ②:试管里澄灰水只变浑浊其原因是草酸气体与石灰水反应生成草酸钙;能验证草酸受热分解的装置是1(填图Ⅱ中的编号“①”或“②”),理由是:因为①中有冷却装置(从装置的特点分析).
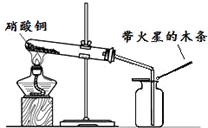 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,某兴趣小组对它开展了以下研究.
硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,某兴趣小组对它开展了以下研究.(1)硝酸铜的制备研究
该小组同学查阅资料发现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O
甲同学认为三种方案的反应都可以在铁制容器中进行,乙同学认为不可行(填“可行”“不
可行”),理由是(用一个化学方程式表示)Fe+Cu(NO3)2═Cu+Fe(NO3)2.从环境保护和经济效益角度考虑,制取大量的硝酸铜最宜采用以上方法③,理由是①②产生污染空气的有害气体,③中反应过程没有有毒气体生成,不污染环境,硝酸利用率高.
(2)硝酸铜的性质研究
硝酸铜为蓝色固体,溶于水可得蓝色溶液.该小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4═CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解,过 滤,向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤II:在如图的试管和集气瓶之间连上此图所示的装置,重新进行加热硝酸铜的实验 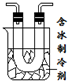 | 集气瓶中气体为无色,带火星的木条复燃 带火星的木条复燃 | 硝酸铜分解生成了氧气 |
【获得结论】根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
该小组同学取10g的硝酸铜加热一段时间后,测得剩余固体的质量为4.6g,则硝酸铜的分解率为9.2%?(分解率为已分解的硝酸铜占原硝酸铜的质量分数,写出计算过程)
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
| A. | 维生素 | B. | 油脂 | C. | 蛋白质 | D. | 无机盐 |
| A. | Fe、Ag、CuSO4溶液 | B. | Cu、Ag、Fe、稀盐酸 | ||
| C. | Cu、FeCl2溶液、AgNO3溶液 | D. | Fe、Cu、AgNO3溶液 稀盐酸 |

 A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去).
A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去). 下列用字母表示的8种物质由H、C、O、Na、Cl、Ca中的几种元素组成,它们是初中化学常见的物质.
下列用字母表示的8种物质由H、C、O、Na、Cl、Ca中的几种元素组成,它们是初中化学常见的物质.