题目内容
20.实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色的粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则变质反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和的碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入足量的氯化钙溶液; | 白色沉淀产生 | 该反应的化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl |
| (2)将上述反应后的混合液过滤, 取滤液加入无色酚酞试液. | 酚酞试液变红色 | 证明猜想Ⅱ成立 |
【实验探究2】小红同学设计如图1所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:①按图连接好装置;②用托盘天平准确称取该样品2.0g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢氧化钠溶液220mL.请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检验装置的气密性;
(2)B中集气瓶盛装的饱和碳酸氢钠溶液不能用水代替,其理由是二氧化碳气体部分溶解在水中影响气体体积的测量;
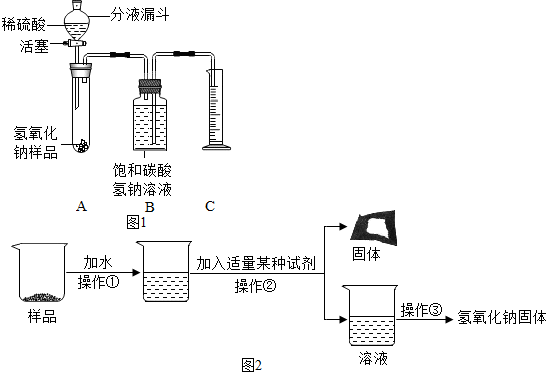
(3)变质氢氧化钠样品中碳酸钠的质量分数为48%.(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【研究与讨论】小明同学认这小红的设计方案过于繁杂,他认为用托盘天平准确称取该样品2.0g后,只需要再称量装置A反应前的总质量(mA前)和完全反应后装置A的总质量(mA后),就能测量出该部分变质样品中碳酸钠的质量分数.
(1)小明认为反应中产生二氧化碳的质量等于mA前-mA后(填数学表达式),从而轻易的计算出该部分变质样品中碳酸钠的质量分数.
(2)小明计算出该部分变质样品中碳酸钠的质量分数的结果数据偏大,请你帮助他分析分析,原因可能是该反应过程中放热反应,导致一部分水以水蒸气的形式逸出.
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如图2所示的实验流程.
请回答下列问题:
(1)操作②中加入的适量某种试剂是氢氧化钙溶液(只写一种);
(2)最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”).
【实验反思】
实验探究1中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,请说出其中一个目的:将碳酸钠转化为碳酸钙,以免干扰氢氧化钠的检验.
分析 【提出猜想】
氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,从而变质;
【实验探究1】
氯化钙和碳酸钠反应生成白色沉淀碳酸钙和氯化钠;
氢氧化钠溶液显碱性,能使酚酞试液变红色;
【实验探究2】
凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
二氧化碳能够溶于水;
根据反应的化学方程式和提供的数据可以计算变质氢氧化钠样品中碳酸钠的质量分数;
【研究与讨论】
反应前后的质量差即为反应生成二氧化碳的质量;
温度升高时,水蒸发的较快;
【实验探究3】
碳酸钠能和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
【实验反思】
相同的操作过程,目的不一定相同.
解答 解:【提出猜想】
氢氧化钠和二氧化碳反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O.
故填:2NaOH+CO2=Na2CO3+H2O.
【实验探究1】
实验操作、实验现象和实验结论如下表所示:
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入足量的氯化钙溶液; | 白色沉淀产生 | 该反应的化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl |
| (2)将上述反应后的混合液过滤, 取滤液加入无色酚酞试液. | 酚酞试液变红色 | 证明猜想Ⅱ成立 |
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检验装置的气密性;
(2)B中集气瓶盛装的饱和碳酸氢钠溶液不能用水代替,其理由是二氧化碳气体部分溶解在水中影响气体体积的测量;
(3)设碳酸钠的质量为x,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
106 44
x 1.8g/L×0.22L
$\frac{106}{x}$=$\frac{44}{1.8g/L×0.22L}$,
x=0.954g,
变质氢氧化钠样品中碳酸钠的质量分数为:$\frac{0.954g}{2.0g}$×100%=48%.
故填:检验装置的气密性;二氧化碳气体部分溶解在水中影响气体体积的测量;48%.
【研究与讨论】
(1)小明认为反应中产生二氧化碳的质量等于mA前-mA后,从而轻易的计算出该部分变质样品中碳酸钠的质量分数.
(2)原因可能是该反应过程中放热反应,导致一部分水以水蒸气的形式逸出.
故填:mA前-mA后;该反应过程中放热反应,导致一部分水以水蒸气的形式逸出.
【实验探究3】
(1)操作②中加入的适量某种试剂是氢氧化钙溶液或氢氧化钡溶液;
(2)最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量,这是因为反应生成了一部分氢氧化钠.
故填:氢氧化钙溶液;大于.
【实验反思】
实验探究1中,将碳酸钠转化为碳酸钙,以免干扰氢氧化钠的检验;
实验探究3中,将碳酸钠转化为氢氧化钠,变废为宝.
故填:将碳酸钠转化为碳酸钙,以免干扰氢氧化钠的检验.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
10.建设节约型社会人人有责,下列节约行为中可行的是( )
| A. | 直接用工厂排出的废水灌溉农田 | B. | 吃经蒸煮后的变质大米 | ||
| C. | 将用剩的药品放回原试剂瓶 | D. | 改用节水水笼头 |
11.小明发现实验桌上有瓶敞口长久放置的NaOH溶液,以下是他对溶液的探究.
【提出问题】这瓶NaOH溶液一定变质了,其变质的程度如何呢?
【提出猜想】小明的猜想:NaOH溶液部分变质A.你的新猜想:NaOH溶液完全变质;
【实验探究】小明设计如下实验验证自己的猜想,请根据表中内容填写实验现象:
上述发生反应的化学方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl.
B.假设你的猜想正确,并按上表方案进行实验,则
【实验反思】下列物质①BaCl2溶液 ②Ca(OH)2溶液 ③Ba(OH)2溶液 ④Ca(NO3 )2溶液,不能代替实验中CaCl2溶液的是②③ (填序号);
【应用拓展】保存NaOH溶液的方法是密封.
【提出问题】这瓶NaOH溶液一定变质了,其变质的程度如何呢?
【提出猜想】小明的猜想:NaOH溶液部分变质A.你的新猜想:NaOH溶液完全变质;
【实验探究】小明设计如下实验验证自己的猜想,请根据表中内容填写实验现象:
| 实验步骤 | 现 象 | 结 论 |
| 取少量该样品放在试管中,先滴 加足量的CaCl2溶液,过滤,然后 在滤液中滴加酚酞试液 | 溶液中开始生成白色沉淀,后溶液变红色 | NaOH溶液部分变质 |
B.假设你的猜想正确,并按上表方案进行实验,则
| 实验步骤 | 现 象 | 结 论 |
| 取少量该样品放在试管中,先滴加 足量的CaCl2溶液,过滤,然后在 滤液中滴加酚酞试液 | 开始时出现白色沉淀,然后再加酚酞试液无明显变色现象 | 结论:我的 猜想正确 |
【应用拓展】保存NaOH溶液的方法是密封.
8.有关化学实验的下列操作中,一般情况下不能相互接触的是( )
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗径与烧杯内壁 | |
| C. | 向试管中倾倒液体时,瓶口与试管口 | |
| D. | 用胶头滴管向试管滴液体时,胶头滴管尖端与试管内壁 |
5.氧气是我们身边常见的物质,以下有关氧气的叙述不正确的是( )
| A. | 氧气具有可燃性 | B. | 氧气能提供动植物呼吸 | ||
| C. | 氧气能支持燃烧 | D. | 氧气的密度比空气稍大 |
9. 在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.
在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.
【查阅资料】①过氧化钠是一种淡黄色固体 ②过氧化钠能与水反应,生成氢氧化钠和氧气 ③过氧化钠能与二氧化碳反应,生成碳酸钠和氧气
【分析讨论】
(1)根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是放热(填“吸热”或“放热”)反应.
(2)小陈同学认为从物理性质角度看该样品中肯定不含过氧化钠,他的理由是过氧化钠为淡黄色,但小李同学觉得不可靠,他取了一些样品加入适量的水,观察到不产生气泡(填现象),证明了小陈同学的判断是正确的.
【猜想假设】
猜想一:样品中只有NaOH
猜想二:样品中含有Na2CO3和NaOH
猜想三:样品中只含Na2CO3
【实验探究】
为了证明以上猜想,甲乙丙三个同学利用小李同学所得的溶液,分别进行了如下三个实验方案的探究:
(1)上述实验方案中,实验操作、现象和结论都正确的是丙(填序号).
(2)实验操作中存在的错误是将pH试纸直接浸入溶液中测pH.
(3)实验方案中也有错误,请说出有错误的实验方案以及错误的原因甲实验不正确,因为碳酸钠溶液也显碱性;乙实验也不正确,因为溶液中的氢氧化钠先与加入的少量盐酸反应,即使溶液中有碳酸钠也可能不产生气体.
【继续探究】
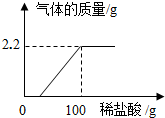
在老师的带领下,同学们称取了一定质量的样品,加入足量的水,配成了50g溶液,再向所配得的溶液中逐滴滴加溶质质量分数为7.3%的稀盐酸,并精确测量溶液的质量,根据实验数据绘制出如图所示稀盐酸的质量与生成气体质量的关系图.试计算:
(1)变质前过氧化钠的质量为7.8g;
(2)恰好完全反应时所得溶液中溶质的质量分数为7.9%.
【反思】过氧化钠保存时应该密封保存.
 在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.
在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.【查阅资料】①过氧化钠是一种淡黄色固体 ②过氧化钠能与水反应,生成氢氧化钠和氧气 ③过氧化钠能与二氧化碳反应,生成碳酸钠和氧气
【分析讨论】
(1)根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是放热(填“吸热”或“放热”)反应.
(2)小陈同学认为从物理性质角度看该样品中肯定不含过氧化钠,他的理由是过氧化钠为淡黄色,但小李同学觉得不可靠,他取了一些样品加入适量的水,观察到不产生气泡(填现象),证明了小陈同学的判断是正确的.
【猜想假设】
猜想一:样品中只有NaOH
猜想二:样品中含有Na2CO3和NaOH
猜想三:样品中只含Na2CO3
【实验探究】
为了证明以上猜想,甲乙丙三个同学利用小李同学所得的溶液,分别进行了如下三个实验方案的探究:
| 序号 | 实验操作 | 实验现象 | 结论 |
| 甲 | 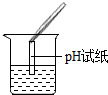 | 试纸变色,对比比色卡,pH>7 | 样品中一定含NaOH |
| 乙 | 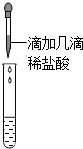 | 没有气体产生 | 样品中一定不含Na2CO3 |
| 丙 | 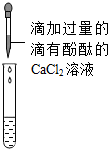 | 产生沉淀,且溶液变成红色 | 样品中含Na2CO3和NaOH |
(2)实验操作中存在的错误是将pH试纸直接浸入溶液中测pH.
(3)实验方案中也有错误,请说出有错误的实验方案以及错误的原因甲实验不正确,因为碳酸钠溶液也显碱性;乙实验也不正确,因为溶液中的氢氧化钠先与加入的少量盐酸反应,即使溶液中有碳酸钠也可能不产生气体.
【继续探究】
在老师的带领下,同学们称取了一定质量的样品,加入足量的水,配成了50g溶液,再向所配得的溶液中逐滴滴加溶质质量分数为7.3%的稀盐酸,并精确测量溶液的质量,根据实验数据绘制出如图所示稀盐酸的质量与生成气体质量的关系图.试计算:
(1)变质前过氧化钠的质量为7.8g;
(2)恰好完全反应时所得溶液中溶质的质量分数为7.9%.
【反思】过氧化钠保存时应该密封保存.
10.A、B、C三种元素的化合价分别是+1、+4、-2,这三种元素组成的化合物的化学式可能是( )
| A. | ABC4 | B. | A3BC2 | C. | A4BC3 | D. | A2BC3 |



 ”构成的物质浓度越大,反应速率越快的微观原因是氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.
”构成的物质浓度越大,反应速率越快的微观原因是氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.
