题目内容
15.从微观的角度认识物质及其变化,更有助于了解物质组成及变化的本质.(1)从图中不能获取的信息是B(填序号).
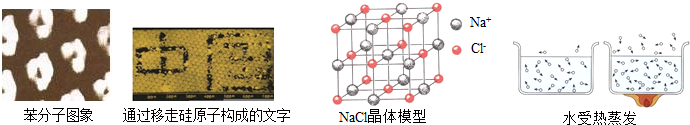
A.构成物质的粒子之间有间隔 B.硅原子是由原子核和电子构成的
C.受热水分子运动速率加快 D.构成物质的粒子有分子、原子和离子
(2)如图是元素周期表的一部分(数字表示相应元素的原子序数)及氧元素的原子结构示意图,试回答有关问题:

①将氧元素的符号填入表中相应位置,填写依据是氧元素的原子序数是8,应该排在氟元素的前面.
②表中镁元素的每个原子需要失去2个电子形成相对稳定结构的离子,该离子与F-形成化合物的化学式为MgF2.
(3)氢氧化钠溶液与盐酸反应的本质是氢离子与氢氧根离子结合生成水,即H++OH-=H2O.如图所示氯化钙溶液与碳酸钠溶液反应的微观过程,该反应的本质是钙离子和碳酸根离子结合生成碳酸钙沉淀.请写出一个与上述反应本质相同但反应物不同的化学反应方程式:Ca(NO3)2+K2CO3=2KNO3+CaCO3↓.

(4)如图所示是某反应中粒子的变化示意图:

①写出该反应的化学方程式:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2;
②反应中由“
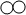 ”构成的物质浓度越大,反应速率越快的微观原因是氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.
”构成的物质浓度越大,反应速率越快的微观原因是氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.
分析 (1)根据图中通过的信息可以判断相关方面的问题;
(2)元素周期表中,由左至右元素的原子序数是依次增大的;
镁原子的最外层电子数是2,在反应中容易失去,从而变成带2个单位正电荷的镁离子;
(3)氯化钙和碳酸钠反应生成白色沉淀碳酸钙和氯化钠;
硝酸钙和碳酸钾反应生成碳酸碳酸钙沉淀和硝酸钾;
(4)根据反应中粒子的变化示意图可以判断出:一氧化碳燃烧生成二氧化碳;
解答 解:(1)A、苯分子图象及水受热蒸发的图片,都可以表示出构成物质的分子间存在间隔,该选项说法正确;
B、通过移走硅原子构成文字的图片中的文字是移走原子后所形成的,此图表示由原子构成的物质中原子可以进行移动但却不能说明原子的内部构成,该选项说法不正确;
C、水受热蒸发前后相比,加热后扩散入空气中的水分子明显增加,可说明受热能使水分子运动速率加快,该选项说法正确;
D、食盐晶体模型图片表示氯化钠由钠离子和氯离子构成;而苯分子图象及水受热蒸发的图片可表示物质由分子构成;通过移走硅原子构成文字的图片则可以表示物质由原子构成,该选项说法正确.
故选:B.
(2)①氧原子的核内质子数是8个,说明氧元素的原子序数是8,应该排在氟元素的前面,如下图所示:
填写依据是氧元素的原子序数是8,应该排在氟元素的前面;
②表中镁元素的每个原子需要失去2个电子形成相对稳定结构的离子,该离子与F-形成化合物的化学式为MgF2.
故填:氧元素的原子序数是8,应该排在氟元素的前面;2;MgF2.
(3)氯化钙溶液与碳酸钠溶液反应的微观过程,该反应的本质是钙离子和碳酸根离子结合生成碳酸钙沉淀;
与上述反应本质相同但反应物不同的化学反应是硝酸钙和碳酸钾反应生成碳酸钙和硝酸钾,反应的化学方程式为:Ca(NO3)2+K2CO3=2KNO3+CaCO3↓.
故填:钙离子和碳酸根离子结合生成碳酸钙沉淀;Ca(NO3)2+K2CO3=2KNO3+CaCO3↓.
(4)①该反应中,一氧化碳燃烧生成了二氧化碳,反应的化学方程式为:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2;
②反应中由“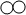 ”构成的物质氧气的浓度越大,反应速率越快的微观原因是:氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.
”构成的物质氧气的浓度越大,反应速率越快的微观原因是:氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.
故填:氧气的浓度越大,单位体积内氧分子的个数越多,与一氧化碳分子结合生成二氧化碳分子的个数越多,因此反应速率越快.
点评 构成物质的基本微粒有分子、原子和离子三种,正是这三种基本微粒,构成了自然界形形色色的物质,要注意理解.

 阅读快车系列答案
阅读快车系列答案| A. | ①②③④ | B. | ①②④⑤⑥ | C. | ①③④⑦ | D. | ②③④⑦ |
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则变质反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和的碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入足量的氯化钙溶液; | 白色沉淀产生 | 该反应的化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl |
| (2)将上述反应后的混合液过滤, 取滤液加入无色酚酞试液. | 酚酞试液变红色 | 证明猜想Ⅱ成立 |
【实验探究2】小红同学设计如图1所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:①按图连接好装置;②用托盘天平准确称取该样品2.0g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢氧化钠溶液220mL.请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检验装置的气密性;
(2)B中集气瓶盛装的饱和碳酸氢钠溶液不能用水代替,其理由是二氧化碳气体部分溶解在水中影响气体体积的测量;
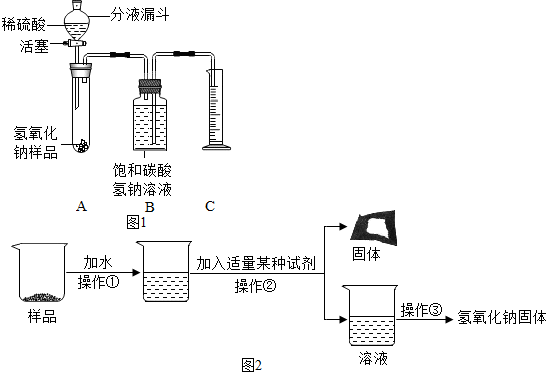
(3)变质氢氧化钠样品中碳酸钠的质量分数为48%.(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【研究与讨论】小明同学认这小红的设计方案过于繁杂,他认为用托盘天平准确称取该样品2.0g后,只需要再称量装置A反应前的总质量(mA前)和完全反应后装置A的总质量(mA后),就能测量出该部分变质样品中碳酸钠的质量分数.
(1)小明认为反应中产生二氧化碳的质量等于mA前-mA后(填数学表达式),从而轻易的计算出该部分变质样品中碳酸钠的质量分数.
(2)小明计算出该部分变质样品中碳酸钠的质量分数的结果数据偏大,请你帮助他分析分析,原因可能是该反应过程中放热反应,导致一部分水以水蒸气的形式逸出.
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如图2所示的实验流程.
请回答下列问题:
(1)操作②中加入的适量某种试剂是氢氧化钙溶液(只写一种);
(2)最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”).
【实验反思】
实验探究1中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,请说出其中一个目的:将碳酸钠转化为碳酸钙,以免干扰氢氧化钠的检验.
| A. | CuO | B. | Al2O3 | C. | CaO | D. | ZnO |
| A. | 浓硫酸暴露在空气中,溶液的质量会变大 | |
| B. | 铝丝表面形成致密的保护膜 | |
| C. | 浓盐酸敞口放置,溶质的质量分数会变小 | |
| D. | 生石灰暴露在空气中会变质 |
| A. | 潮湿的衣服在阳光下晒干 | B. | 蜡烛燃烧越来越短 | ||
| C. | 铁丝燃烧后产物质量增加 | D. | 高锰酸钾受热后质量减小 |
