题目内容
10.建设节约型社会人人有责,下列节约行为中可行的是( )| A. | 直接用工厂排出的废水灌溉农田 | B. | 吃经蒸煮后的变质大米 | ||
| C. | 将用剩的药品放回原试剂瓶 | D. | 改用节水水笼头 |
分析 实施可持续发展战略,建设节约型社会就要求我们节能减排,淘汰高耗能产业,开发新能源.根据根据节约用水、水的污染、剩余药品的处理方法、变质食品的处理方法来回答本题.
解答 解:
A、为了提高水资源的利用率,工厂排放的废水含有有毒物质,要经过处理后再灌溉农田,故此说法不正确.
B、霉变大米含有黄曲霉素,性质比较稳定,对加热后的霉变食品业不能食用.所以不正确.
C、实验室剩的药品要分情况处理,要求放在指定的容器内,所以不正确.
D、改用节水水龙头,可以节约水资源,所以正确.
故选D
点评 环境、食品、能源等关系这人类的健康和生存,所以有关生产、生活实际问题的考查也成为中考重点之一.

练习册系列答案
相关题目
20.小雨同学利用学过的化学知识判断家中的玻璃杯是否洗涤干净的依据是( )
| A. | 杯子内壁看不见油污 | |
| B. | 杯壁上的水不集成水滴,也不成股流下,而是覆盖一层均匀的水膜 | |
| C. | 用杯子装水,水是澄清透明的 | |
| D. | 用蒸馏水洗过多次 |
1.下列数据是一些物质的pH,其中呈碱性的是( )
| A. |  (8-9)牙膏 | B. |  (6-7)胡萝卜 | C. |  (3-4)橘子 | D. |  (2-3)食醋 |
15.下列化学反应中,属于复分解反应的是( )
| A. | Fe+CuSO4═FeSO4+Cu | B. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2H2O | ||
| C. | CO2+H2O═H2CO3 | D. | NaOH+HCl═NaCl+H2O |
2.下列叙述与对应的示意图表示正确的是( )
| A. |  向一定量的硫酸铜溶液中加铁粉 | |
| B. |  向一定量pH=2的盐 酸中逐滴加水稀释 | |
| C. |  电解一定质量的水 | |
| D. | 等 质量的锌、铁与足量等浓度稀硫酸反应 |
20.实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色的粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则变质反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和的碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】小红同学设计如图1所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:①按图连接好装置;②用托盘天平准确称取该样品2.0g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢氧化钠溶液220mL.请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检验装置的气密性;
(2)B中集气瓶盛装的饱和碳酸氢钠溶液不能用水代替,其理由是二氧化碳气体部分溶解在水中影响气体体积的测量;
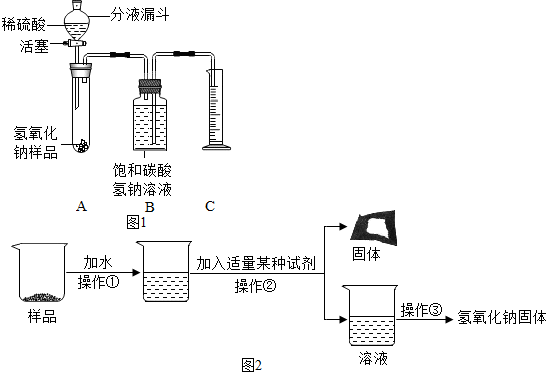
(3)变质氢氧化钠样品中碳酸钠的质量分数为48%.(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【研究与讨论】小明同学认这小红的设计方案过于繁杂,他认为用托盘天平准确称取该样品2.0g后,只需要再称量装置A反应前的总质量(mA前)和完全反应后装置A的总质量(mA后),就能测量出该部分变质样品中碳酸钠的质量分数.
(1)小明认为反应中产生二氧化碳的质量等于mA前-mA后(填数学表达式),从而轻易的计算出该部分变质样品中碳酸钠的质量分数.
(2)小明计算出该部分变质样品中碳酸钠的质量分数的结果数据偏大,请你帮助他分析分析,原因可能是该反应过程中放热反应,导致一部分水以水蒸气的形式逸出.
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如图2所示的实验流程.
请回答下列问题:
(1)操作②中加入的适量某种试剂是氢氧化钙溶液(只写一种);
(2)最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”).
【实验反思】
实验探究1中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,请说出其中一个目的:将碳酸钠转化为碳酸钙,以免干扰氢氧化钠的检验.
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则变质反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和的碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入足量的氯化钙溶液; | 白色沉淀产生 | 该反应的化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl |
| (2)将上述反应后的混合液过滤, 取滤液加入无色酚酞试液. | 酚酞试液变红色 | 证明猜想Ⅱ成立 |
【实验探究2】小红同学设计如图1所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:①按图连接好装置;②用托盘天平准确称取该样品2.0g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢氧化钠溶液220mL.请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检验装置的气密性;
(2)B中集气瓶盛装的饱和碳酸氢钠溶液不能用水代替,其理由是二氧化碳气体部分溶解在水中影响气体体积的测量;

(3)变质氢氧化钠样品中碳酸钠的质量分数为48%.(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【研究与讨论】小明同学认这小红的设计方案过于繁杂,他认为用托盘天平准确称取该样品2.0g后,只需要再称量装置A反应前的总质量(mA前)和完全反应后装置A的总质量(mA后),就能测量出该部分变质样品中碳酸钠的质量分数.
(1)小明认为反应中产生二氧化碳的质量等于mA前-mA后(填数学表达式),从而轻易的计算出该部分变质样品中碳酸钠的质量分数.
(2)小明计算出该部分变质样品中碳酸钠的质量分数的结果数据偏大,请你帮助他分析分析,原因可能是该反应过程中放热反应,导致一部分水以水蒸气的形式逸出.
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如图2所示的实验流程.
请回答下列问题:
(1)操作②中加入的适量某种试剂是氢氧化钙溶液(只写一种);
(2)最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”).
【实验反思】
实验探究1中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,请说出其中一个目的:将碳酸钠转化为碳酸钙,以免干扰氢氧化钠的检验.
