题目内容
10.A、B、C三种元素的化合价分别是+1、+4、-2,这三种元素组成的化合物的化学式可能是( )| A. | ABC4 | B. | A3BC2 | C. | A4BC3 | D. | A2BC3 |
分析 在化合物中正负化合价代数和为零,将三种元素的化合价代入选项,如果化合物的各元素化合价的代数和为零,则表明该化学式正确.
解答 解:A.A、B、C三种元素的化合价分别是+1、+4、-2,则化合物ABC4中各元素的化合价代数和为(+1)+(+4)+(-2)×4=-3≠0,根据化合物中各元素化合价代数和为0,可判断该化学式没有可能,故选项错误.
B.A、B、C三种元素的化合价分别是+1、+4、-2,则化合物A3BC2中各元素的化合价代数和为(+1)×3+(+4)+(-2)×2=+3≠0,根据化合物中各元素化合价代数和为0,可判断该化学式没有可能,故选项错误.
C.A、B、C三种元素的化合价分别是+1、+4、-2,则化合物A4BC3中各元素的化合价代数和为(+1)×4+(+4)+(-2)×3=+2≠0,根据化合物中各元素化合价代数和为0,可判断该化学式没有可能,故选项错误.
D.A、B、C三种元素的化合价分别是+1、+4、-2,则化合物A2BC3中各元素的化合价代数和为(+1)×2+(+4)+(-2)×3×2=0,根据化合物中各元素化合价代数和为0,可判断该化学式有可能,故选项正确.
故选D.
点评 本题难度不大,根据化合物中各元素化合价代数和为0,利用化合物中各元素的化合价,可判断所书写的化学式是否正确.

练习册系列答案
相关题目
20.实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色的粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则变质反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和的碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】小红同学设计如图1所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:①按图连接好装置;②用托盘天平准确称取该样品2.0g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢氧化钠溶液220mL.请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检验装置的气密性;
(2)B中集气瓶盛装的饱和碳酸氢钠溶液不能用水代替,其理由是二氧化碳气体部分溶解在水中影响气体体积的测量;
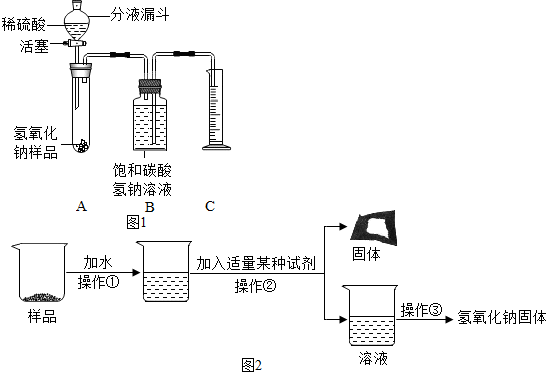
(3)变质氢氧化钠样品中碳酸钠的质量分数为48%.(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【研究与讨论】小明同学认这小红的设计方案过于繁杂,他认为用托盘天平准确称取该样品2.0g后,只需要再称量装置A反应前的总质量(mA前)和完全反应后装置A的总质量(mA后),就能测量出该部分变质样品中碳酸钠的质量分数.
(1)小明认为反应中产生二氧化碳的质量等于mA前-mA后(填数学表达式),从而轻易的计算出该部分变质样品中碳酸钠的质量分数.
(2)小明计算出该部分变质样品中碳酸钠的质量分数的结果数据偏大,请你帮助他分析分析,原因可能是该反应过程中放热反应,导致一部分水以水蒸气的形式逸出.
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如图2所示的实验流程.
请回答下列问题:
(1)操作②中加入的适量某种试剂是氢氧化钙溶液(只写一种);
(2)最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”).
【实验反思】
实验探究1中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,请说出其中一个目的:将碳酸钠转化为碳酸钙,以免干扰氢氧化钠的检验.
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则变质反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和的碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入足量的氯化钙溶液; | 白色沉淀产生 | 该反应的化学方程式:CaCl2+Na2CO3=CaCO3↓+2NaCl |
| (2)将上述反应后的混合液过滤, 取滤液加入无色酚酞试液. | 酚酞试液变红色 | 证明猜想Ⅱ成立 |
【实验探究2】小红同学设计如图1所示装置(铁架台略去),实验在27℃,101kPa下进行,步骤如下:①按图连接好装置;②用托盘天平准确称取该样品2.0g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢氧化钠溶液220mL.请回答下列问题:
(1)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检验装置的气密性;
(2)B中集气瓶盛装的饱和碳酸氢钠溶液不能用水代替,其理由是二氧化碳气体部分溶解在水中影响气体体积的测量;

(3)变质氢氧化钠样品中碳酸钠的质量分数为48%.(在27℃,101kPa时二氧化碳的密度为1.8g/L)(计算结果精确至1%)
【研究与讨论】小明同学认这小红的设计方案过于繁杂,他认为用托盘天平准确称取该样品2.0g后,只需要再称量装置A反应前的总质量(mA前)和完全反应后装置A的总质量(mA后),就能测量出该部分变质样品中碳酸钠的质量分数.
(1)小明认为反应中产生二氧化碳的质量等于mA前-mA后(填数学表达式),从而轻易的计算出该部分变质样品中碳酸钠的质量分数.
(2)小明计算出该部分变质样品中碳酸钠的质量分数的结果数据偏大,请你帮助他分析分析,原因可能是该反应过程中放热反应,导致一部分水以水蒸气的形式逸出.
【提出问题3】怎样提纯该样品得到纯净的氢氧化钠固体?
【实验探究3】为得到纯净的氢氧化钠固体,小亮设计了如图2所示的实验流程.
请回答下列问题:
(1)操作②中加入的适量某种试剂是氢氧化钙溶液(只写一种);
(2)最终所得氢氧化钠固体质量大于变质后样品中氢氧化钠的质量(填“小于”、“等于”或“大于”).
【实验反思】
实验探究1中的检验和实验探究3中的除杂都将碳酸钠进行了转化,但二者目的不同,请说出其中一个目的:将碳酸钠转化为碳酸钙,以免干扰氢氧化钠的检验.
1.区别空气、CO2、O2三种气体最简便的方法是( )
| A. | 将气体分别通入澄清的石灰水中 | B. | 观察气体的颜色 | ||
| C. | 将燃烧的木条分别伸入集气瓶中 | D. | 将气体分别通入水中 |
18.工业酒精中常含有甲醇(CH3OH),误食后会使人眼睛失明,甚至死亡.下列有关甲醇的说法正确的是( )
| A. | 甲醇属于氧化物 | |
| B. | 甲醇由碳、氢、氧三种元素组成 | |
| C. | 甲醇中碳、氢、氧三种元素的质量比为1:4:1 | |
| D. | 甲醇由1个碳原子、4个氢原子和1个氧原子构成 |
5.下列不能用质量守恒定律解释的是( )
| A. | 潮湿的衣服在阳光下晒干 | B. | 蜡烛燃烧越来越短 | ||
| C. | 铁丝燃烧后产物质量增加 | D. | 高锰酸钾受热后质量减小 |
2.由以下粒子结构示意图得出的结论中,错误的是( )


| A. | 在化合物中,①可显-2价,⑤可显+2价 | |
| B. | ①②为非金属元素的原子,④⑤为金属元素的原子 | |
| C. | ③为相对稳定结构,一般不易得失电子 | |
| D. | 上述粒子在发生化学反应时,质子数、电子数均发生改变 |
19.某溶液的pH=0,则该溶液( )?
| A. | 呈中性 | B. | 呈酸性 | C. | 呈碱性 | D. | 是纯水 |
20.下列图示是化学实验的基本操作,其中正确的是( )
| A. |  读液体体积 | B. |  点燃酒精灯 | C. |  检查气密性 | D. |  过滤 |