题目内容
6.CO 是工业中重要的还原剂,甲乙两同学在实验室中采用CO和CuO作为反应物进行相关实验探究.【探究活动一】甲乙两位同学设计了如图1实验装置验证一氧化碳的部分性质并验证产物.实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验.
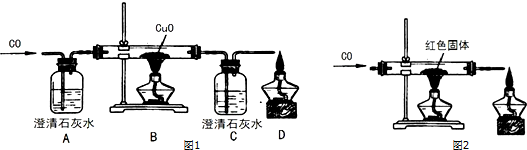
①实验过程中,C 中的现象是澄清石灰水变浑浊,D 处点燃的目的是把一氧化碳转化成二氧化碳,D 处发生的反应方程式为2CO+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2.
②对该实验的分析正确的是AD
A.实验结束时应先熄灭 B 处酒精灯
B.C 中增加的质量与B中固体减少的质量相等 C.实验中若通入 28g 一氧化碳可生成 64g 铜 D.反应结束后继续通入一氧化碳的目的之一是防止铜被氧化
③甲同学认为 A 装置用于证明一氧化碳不能和石灰水反应,乙同学认为省略 A 可达到同 样的目的,理由是为了排尽装置中的空气,反应前已经通入一定量的一氧化碳.
【探究活动二】甲同学不小心将探究一得到的部分红色固体洒落到稀硫酸中,发现溶液的颜色由无色
变为蓝色.两位同学对该现象产生的原因感到不解,向老师求助,老师向他们提供了以下 资料,并鼓励他们继续探究红色固体的成分.
【资料】
Ⅰ.氧化铜被还原的过程可能会生成氧化亚铜(Cu2O),Cu2O 也能被还原成铜;Ⅱ.Cu和Cu2O均为不溶于水的红色固体;
Ⅲ.Cu2O+H2SO4═CuSO4+Cu+H2O
结合刚才的实验现象,两位同学对红色固体的成分提出两种猜想:猜想①:是Cu2O和Cu; 猜想②:是Cu2O.
经过讨论交流,两位同学再次实验,并采取了不同的方案验证了猜想.
【方案一】.
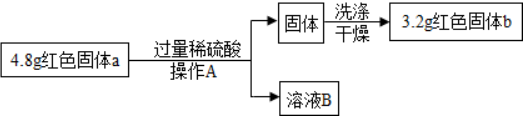
①操作A为过滤,加过量硫酸的目的是使氧化亚铜完全反应,溶液B中含有的溶质是硫酸、硫酸铜,洗涤的目的是除去铜表面的杂质.
②大家通过以上数据计算并判断出猜想①成立,请你帮他们计算红色固体a中Cu2O的质量为2.88g.(无需写出计算过程)
③老师看了小组同学的实验报告后,高度赞扬了两位同学的实验设计,并指出两位同学
的实验过程中若出现以下失误,会使红色固体a中Cu2O的质量分数偏小的是ABC
A.稀硫酸量不足
B.反应后未洗涤剩余的红色固体就直接进行了干燥
C.采用加热烘干的方式干燥剩余红色固体
D.将红色固体b转移到天平上时有少量洒落
【方案二】用图2装置进行实验,通过测量反应前后固体质量的方法也能确定哪种猜想成立. 甲乙同学经过计算验证出猜想①正确,请你写出CO与红色固体反应的化学方程式:CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2.
分析 【探究活动一】
二氧化碳能使澄清石灰变浑浊;
一氧化碳燃烧生成二氧化碳;
高温条件下,铜能和空气中的氧气反应生成氧化铜;
为了防止一氧化碳和空气混合点燃时发生爆炸,加热前应该通入一会儿一氧化碳;
【探究活动二】
红色固体可能是Cu2O和Cu,也可能是Cu2O;
过滤可以把不溶于水的物质除去;
根据提供的数据可以计算氧化亚铜的质量;
如果操作不当,会影响实验结果,甚至会导致实验失败;
加热条件下,氧化铜和一氧化碳反应生成铜和二氧化碳.
解答 解:【探究活动一】
①实验过程中,C中的现象是澄清石灰水变浑浊,D处点燃的目的是把一氧化碳转化成二氧化碳,D处发生的反应方程式为:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2.
故填:澄清石灰水变浑浊;把一氧化碳转化成二氧化碳;2CO+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2.
②A.实验结束时应先熄灭B处酒精灯,继续通入一氧化碳直至冷却至室温,该选项说法正确;
B.C中增加的质量与B中固体减小的质量不相等,C中增加的质量大于B中固体减小的质量,该选项说法不正确;
C.因为一氧化碳不能完全反应,因此实验中若通入28g一氧化碳时,生成铜的质量小于64g,该选项说法不正确;
D.反应结束后继续通入一氧化碳的目的之一是防止铜被氧化,该选项说法正确.
故填:AD.
③甲同学认为A装置用于证明一氧化碳不能和石灰水反应,乙同学认为省略A可达到同样的目的,理由是为了排尽装置中的空气,反应前已经通入一定量的一氧化碳,过程中C中的澄清石灰水不变浑浊,说明一氧化碳不能和石灰水反应.
故填:为了排尽装置中的空气,反应前已经通入一定量的一氧化碳.
【探究活动二】
猜想①:是Cu2O和Cu;猜想②:是Cu2O.
故填:Cu2O.
①操作A为过滤,加过量硫酸的目的是使氧化亚铜完全反应,溶液B中含有的溶质是过量的硫酸和生成的硫酸铜,洗涤的目的是除去铜表面的杂质.
故填:过滤;使氧化亚铜完全反应;硫酸、硫酸铜;除去铜表面的杂质.
②设氧化亚铜质量为x,
Cu2O+H2SO4=CuSO4+Cu+H2O,
144 64
x $\frac{64x}{144}$
根据题意有:4.8g-x+$\frac{64x}{144}$=3.2g,
x=2.88g,
故填:2.88g.
③A.稀硫酸量不足,氧化亚铜不能完全反应,会导致红色固体a中Cu2O的质量分数偏小;
B.反应后未洗涤剩余的红色固体就直接进行了干燥,导致铜的质量偏大,从而导致红色固体a中Cu2O的质量分数偏小;
C.采用加热烘干的方式干燥剩余红色固体时,铜能和氧气反应生成氧化铜,导致铜的质量偏大,从而导致红色固体a中Cu2O的质量分数偏小;
D.将红色固体b转移到天平上时有少量洒落,导致铜的质量偏小,从而导致红色固体a中Cu2O的质量分数偏大.
故填:ABC.
高温条件下,氧化铜和一氧化碳反应生成铜和二氧化碳,反应的化学方程式为:CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2.
故填:CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2.
答案:
【探究活动一】
①澄清石灰水变浑浊;把一氧化碳转化成二氧化碳;2CO+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2.
②AD;
③为了排尽装置中的空气,反应前已经通入一定量的一氧化碳;
【探究活动二】Cu2O.
①过滤;使氧化亚铜完全反应;硫酸、硫酸铜;除去铜表面的杂质.
②2.88g
③ABC.
【方案二】CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. | 用灼烧闻气味区分羊毛线和棉线 | |
| B. | 用稀盐酸区分铁粉和碳粉 | |
| C. | 用观察法区分酒精和白醋 | |
| D. | 用尝味道的方法区分厨房中的食盐和蔗糖 |
| 营养成分表 | |
| 项目 | 每100克 |
| 能量 | 1966千焦 |
| 蛋白质 | 7.5克 |
| 脂肪 | 21.8克 |
| 碳水化合物 | 60.7克 |
| 钠 | 2530毫克 |
A.离子 B.分子 C.元素 D.单质
(2)方便面中使用的食盐是加碘盐,人体缺碘可能患有的疾病是甲状腺肿大(填“甲状腺肿大”或“骨质疏松”);
(3)若小明用天然气煮方便面,请写出天然气主要成分燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
(4)中国居民膳食指南建议每天食用不超过6克,假设小明某天吃了100克该方便面,相当于吃了食盐6.4克(保留到小数点后一位).
| A. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| B. | 碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性 | |
| C. | 单质是由一种元素组成的,所以由一种元素组成的物质均为单质 | |
| D. | 化学变化过程中常伴有发光发热等现象,所以凡是有发光发热现象发生的变化一定是化学变化 |
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究.
【查阅资料】
Ⅰ.氢氧化铜在温度70℃-80℃时可分解生成氧化铜;
Ⅱ.四羟基合铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与讨论】小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其他同学一致否定了他的猜测,理由是如分解则会生成氧化铜是黑色固体,而蓝色沉淀消失后是形成亮蓝色溶液.
同学们交流讨论后,提出以下两种猜想.
猜想一:少许氢氧化铜可溶于足量水中.
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色.
【实验探究】同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验.请填写表中空格.
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不溶解,液体仍为无色 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡,固体溶解 | 溶液呈亮蓝色 | 猜想二正确 |
(1)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应依据的实验现象是蓝色沉淀逐渐变为黑色.
(2)写出氢氧化铜受热分解生成黑色固体的化学方程式Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
【实践与运用】将8.0g氢氧化钠完全溶于水形成溶液,向其中加入一定质量的硫酸铜溶液,恰好完全反应,所得混合物总质量为109.8g.计算:
(1)反应产生沉淀的质量.(写出计算过程)
(2)反应后所得溶液的溶质质量分数.(写出计算过程,结果精确到0.1%)
| A. | H2SO4 | B. | HCl | C. | Cu(OH)2 | D. | Ca(OH)2 |
| A. | 两个氧分子:2O | B. | 三个二氧化硫分子:3SO2 | ||
| C. | 水中氧元素的化合价为-2价:H2$\stackrel{2-}{O}$ | D. | 一个钙离子:Ca+2 |
 C60发现使人类了解到一个全新的碳世界,根据图1回答下列问题:
C60发现使人类了解到一个全新的碳世界,根据图1回答下列问题: 水是生命之源,人类的生产、生活离不开水.
水是生命之源,人类的生产、生活离不开水.