题目内容
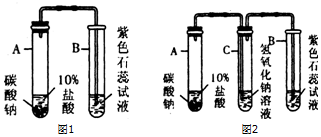
20.某同学用如图装置测定水中氢、氧元素的质量比.其方法是:①测定出通氢气前后Ⅱ的玻璃管(包括内容物)的质量差A克;②测定出通氢气前后Ⅲ的U形管(包括内容物)的质量差 B克;③计算出氢元素和氧元素的质量比.
(1)为了实验的安全进行,他在实验时,先对Ⅰ装置产生的气体进行检验纯度.
(2)该实验中氢元素的质量为$\frac{A}{8}g$克.
(3)若实验过程中,CuO没有全部被还原,对实验结果有什么影响?没有影响.
分析 根据氢气是可燃性气体,不纯时点燃或是加热易产生爆炸进行分析解答,根据氢气还原氧化铜生成铜和水,Ⅱ固体质量差是减少的氧元素的质量进行分析解答,
解答 解:(1)氢气是可燃性气体,不纯时点燃或是加热易产生爆炸,故进行实验前要先检验氢气的纯度,故填:检验纯度;
(2)通氢气前后Ⅱ的玻璃管(包括内容物)的质量差A克,则减少的氧元素的质量为Ag,参加反应的氢气的质量设为x
H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O△m
2 80 64 16
x Ag
$\frac{2}{16}=\frac{x}{Ag}$
x=$\frac{A}{8}g$
故填:$\frac{A}{8}g$;
(3)实验过程中,CuO没有全部被还原,对实验结果没有影响,故填:没有影响.
点评 本考点属于实验探究题,既有气体的制取又有氢气的还原性,还有生成物的检验和对实验的评价,综合性比较强.本题根据题目提供的信息,结合课本中学过的知识来解决,还要注意化学方程式的书写和配平.本考点主要出现在实验题中.

练习册系列答案
相关题目
2.从石灰浆抹的墙壁上掉下一块白色固体,为探究其成分,进行如下实验:
由此得出的结论正确的是( )
| 实验步骤 | 实验现象 |
| ①将固体研磨成粉末状,加水搅拌 | 固体没有全部溶解 |
| ②取上层清液,滴加酚酞试液 | 溶液呈红色 |
| ③取不溶物,滴加稀盐酸 | 有气泡产生 |
| A. | 一定含有CaCO3 和Ca(OH)2 | B. | 一定含有Ca(OH)2,可能含有CaCO3 | ||
| C. | 一定没有CaCO3 和Ca(OH)2 | D. | 一定含有CaCO3,可能含有Ca(OH)2 |
3.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g 样品放入烧杯中,再取60g 稀硫酸分六次加入烧杯中,至充分反应,实验数据如下:
(1)黄铜样品中锌的质量分数为多少?
(2)所用稀硫酸的质量分数为多少?
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | |
| 加入稀硫酸的质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.35 | 8.7 | 8.05 | 7.4 | 6.75 | 6.75 |
(2)所用稀硫酸的质量分数为多少?
15.某同学对Mg、Mn、Ag的金属活动性顺序进行探究.
提出假设:a.Mn的金属活动性比Mg强;b.Mn的金属活动性介于Mg和Ag之间
查阅资料:在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属的活动性越强
实验设计:同温下,取大小相同的Mg、Mn、Ag三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.请回答:
(1)三种金属加入前都先用砂纸将表面擦光亮,其目的是③(填序号)
①使表面光亮,易观察现象 ②使反应金属温度相同,易反应 ③除去氧化膜,利于金属直接与酸反应
(2)根据表中的实验现象填空:
(3)结论:原假设中正确的是b(填“a”或“b”)
上述实验设计中,如果所用盐酸的溶质的质量分数不同,是否一定能得出正确的结论,并说明理由?不能,这是因为其它条件相同时,盐酸质量分数越大,反应速率越快.
提出假设:a.Mn的金属活动性比Mg强;b.Mn的金属活动性介于Mg和Ag之间
查阅资料:在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属的活动性越强
实验设计:同温下,取大小相同的Mg、Mn、Ag三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.请回答:
(1)三种金属加入前都先用砂纸将表面擦光亮,其目的是③(填序号)
①使表面光亮,易观察现象 ②使反应金属温度相同,易反应 ③除去氧化膜,利于金属直接与酸反应
(2)根据表中的实验现象填空:
| / | Mn | Mg | Ag |
| 实验现象 | 产生气泡速率缓慢 | 产生气泡速率快 | 无任何现象 |
上述实验设计中,如果所用盐酸的溶质的质量分数不同,是否一定能得出正确的结论,并说明理由?不能,这是因为其它条件相同时,盐酸质量分数越大,反应速率越快.


 金丽温高速铁路于2016年1月10日正式通车营运,标志着丽水进入了高铁时代,高速铁路铺设的是无缝钢轨,钢铁的主要成分是铁,铁有多种氧化物,请回答:
金丽温高速铁路于2016年1月10日正式通车营运,标志着丽水进入了高铁时代,高速铁路铺设的是无缝钢轨,钢铁的主要成分是铁,铁有多种氧化物,请回答: