题目内容
5.为了测定某碳酸钠样品(其中杂质为氯化钠)的质量分数,小明同学进行了三次实验,反应的化学方程方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl.实验数据如下表:| 编 号 | 第1次 | 第2次 | 第3次 |
| 所取固体样品的质量/g | 7 | 5 | 5 |
| 加入氯化钙溶液的质量/g | 50 | 50 | 75 |
| 反应后生成沉淀的质量/g | 4 | 4 | 4 |
(1)碳酸钠样品中碳酸钠的质量是4.24g.
(2)碳酸钠样品中杂质氯化钠的质量分数是15.2%.
(3)加入氯化钙溶液的溶质质量分数是多少?(请根据化学方程式写出完整的计算步骤)
分析 根据表中数据可知,50g氯化钙溶液和5g样品恰好完全反应生成4g沉淀,根据碳酸钙的质量和对应的化学方程式求算碳酸钠和氯化钙的质量,进而求算对应的质量分数.
解答 解:根据表中数据可知,50g氯化钙溶液和5g样品恰好完全反应生成4g沉淀.
设参加反应的碳酸钠的质量为x,氯化钙的质量为y.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100
x y 4g
$\frac{106}{x}$=$\frac{111}{y}$=$\frac{100}{4g}$
x=4.24g
y=4.44g
碳酸钠样品中碳酸钠的质量是4.24g,
碳酸钠样品中杂质氯化钠的质量分数为$\frac{5g-4.24g}{5g}$×100%=15.2%.
加入氯化钙溶液的溶质质量分数为$\frac{4.44g}{50g}$×100%=8.88%
答:
(1)碳酸钠样品中碳酸钠的质量是 4.24g;
(2)碳酸钠样品中杂质氯化钠的质量分数是 15.2%.
(3)加入氯化钙溶液的溶质质量分数是8.88%
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
相关题目
15.图象能直观地反映某些科学规律,下列图象正确的是( )
| A. | 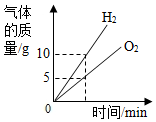 电解水得到H2与O2质量关系 | |
| B. | 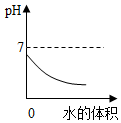 向稀盐酸中加水,溶液的pH变化 | |
| C. |  向NaOH和Na2CO3混合溶液中逐滴滴加稀盐酸 | |
| D. | 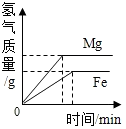 等质量的Mg和Fe与足量相同浓度的稀盐酸反应 |
13.水热反应是指在高温高压的环境条件下,将二氧化碳转化为有机物的技术.水热反应不仅能实现二氧化碳到有机物的转化,还可以将有机物转化成矿物能源,也可将废水中的有机物转化成煤炭等资源.下列说法不正确的是( )
| A. | 水热反应一定包含化学变化 | |
| B. | 水热反应可以降低自然界中碳的含量 | |
| C. | 水热反应可以改善温室效应 | |
| D. | 水热反应可重建地球上碳资源的和谐循环 |
20.下列图象中能正确表达相关化学实验的是( )


| A. | 甲图表示大理石投入足量的盐酸中 | B. | 乙图表示稀盐酸滴入碳酸钠溶液中 | ||
| C. | 丙图表示稀释氯化钠溶液 | D. | 丁图表示稀硫酸滴入氯化钡溶液中 |

