题目内容
16.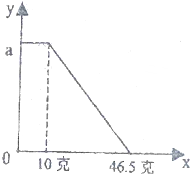 某固体物质由NaOH和MgCl2组成,取一定质量的该混合物溶于水,在所得的悬浊液中逐滴加入溶质质量分数为10%的稀盐酸,发现沉淀的质量(y)与加入盐酸的质量(x)有如图所示的关系,根据此图完成下列问题
某固体物质由NaOH和MgCl2组成,取一定质量的该混合物溶于水,在所得的悬浊液中逐滴加入溶质质量分数为10%的稀盐酸,发现沉淀的质量(y)与加入盐酸的质量(x)有如图所示的关系,根据此图完成下列问题(1)写出得到悬浊液的化学方程式2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(2)先加入的10克盐酸与哪种物质反应?请写出该反应的化学方程式NaOH+HCl═NaCl+H2O;
(3)求原悬浊液中沉淀的质量(写出计算过程)
分析 由图中信息可知,氢氧化钠和氯化镁反应时,氢氧化钠过量,过量的氢氧化钠和稀盐酸反应生成氯化钠和水;反应生成的氢氧化镁和稀盐酸反应生成氯化镁和水,根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)得到悬浊液的反应是氢氧化钠与氯化镁反应,方程式是2NaOH+MgCl2=Mg(OH)2↓+2NaCl,故填:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(2)从图可以看出加入稀盐酸,一开始沉淀的质量不减少,说明一开始稀盐酸与过量的氢氧化钠反应,反应方程式是NaOH+HCl═NaCl+H2O,故填:NaOH+HCl═NaCl+H2O;
(3)设原悬浊液中沉淀的质量为x,
溶解沉淀所消耗氯化氢的质量=(46.5g-10g)×10%=3.65g
Mg(OH)2+2HCl═MgCl2+2H2O
58 73
x 3.65g
$\frac{58}{73}$=$\frac{x}{3.65g}$
x=2.9g,
答:原悬浊液中沉淀的质量为2.9g.
点评 本题主要考查学生利用化学方程式进行计算的能力.本题所涉化学反应较多,解答时需认真分析图示数据和已知条件以及物质间反应的情况,才能正确解答.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
6.某化学兴趣小组的同学在探究Mg、Cu、Fe三种金属的有关性质时进行了如下实验:
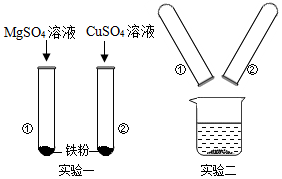
(1)实验一:发生反应的化学方程式Fe+CuSO4═FeSO4+Cu,该实验得出三种金属的活动性由强到弱的顺序为
Mg>Fe>Cu.
(2)实验二:将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,一段时间后过滤.滤渣中一定含有的物质是铜,可能有的物质是铁,为了进一步确定可能有的物质是否存在,同学们设计了如下方案:
(3)滤液中一定含有的金属离子是镁离子、亚铁离子.

(1)实验一:发生反应的化学方程式Fe+CuSO4═FeSO4+Cu,该实验得出三种金属的活动性由强到弱的顺序为
Mg>Fe>Cu.
(2)实验二:将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,一段时间后过滤.滤渣中一定含有的物质是铜,可能有的物质是铁,为了进一步确定可能有的物质是否存在,同学们设计了如下方案:
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤渣于试管中,向其中滴加稀盐酸 | 没有气泡产生 | 滤渣中不含有铁 |
7.下表为元素周期表的部分信息.请回答下列问题.
(1)19世纪60年代,通过对当时发现的63种元素采用科学的分类方法,研制出世界 上第一张元素周期表的科学家是B(填字母序号);
A.道尔顿 B.门捷列夫 C.汤姆生
(2)元素周期表中的分布是有规律的,表中①所代表的元素属于非金属元素(填“金素”或“非金属”);
(3)美国和俄罗斯的科学家,共同合成了中子数为179、相对原子质量为297的超重元素,则该元素原子的质子数为118;
(4)通过观察每一横行的元素,你能发现其中的规律是从左向右原子序数依次递增(一条即可).
| ${\;}_{\;}^{1}$H | 2He | ||||||
| 3Li | 4Be | 5B | 6C | 7N | 8O | ① | 10Ne |
| ② | 12Mg | 13Ai | 14Si | 15P | 16S | ③ | 18Ar |
A.道尔顿 B.门捷列夫 C.汤姆生
(2)元素周期表中的分布是有规律的,表中①所代表的元素属于非金属元素(填“金素”或“非金属”);
(3)美国和俄罗斯的科学家,共同合成了中子数为179、相对原子质量为297的超重元素,则该元素原子的质子数为118;
(4)通过观察每一横行的元素,你能发现其中的规律是从左向右原子序数依次递增(一条即可).
1. 如图,是小明进行粗盐提纯实验时的过滤装置,请结合该实验装置和实验操作判断,以下说法正确的是( )
如图,是小明进行粗盐提纯实验时的过滤装置,请结合该实验装置和实验操作判断,以下说法正确的是( )
 如图,是小明进行粗盐提纯实验时的过滤装置,请结合该实验装置和实验操作判断,以下说法正确的是( )
如图,是小明进行粗盐提纯实验时的过滤装置,请结合该实验装置和实验操作判断,以下说法正确的是( )| A. | 图中还缺少玻璃棒,目的是轻轻搅动漏斗中的液体,以加快过滤速度 | |
| B. | 操作过程中,如果滤液下滴太慢,可能是滤纸对折了两次 | |
| C. | 如果经过一次过滤后,滤液仍浑浊,则应立即检查实验装置并分析原因 | |
| D. | 过滤后的滤液仍然浑浊,有可能是待滤液体液面高于滤纸边缘 |
8.在无色透明的酸性溶液中,能大量共存的一组离子是( )
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、OH-、Cl- | ||
| C. | K+、Mg2+、CO32-、SO42- | D. | Cu2+、Na+、SO42-、Cl- |
5.从所给数据分析,下列选项正确的是( )
| 温度/℃ | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
| A. | 物质的溶解度均随温度的升高而增大或随温度的降低而减少 | |
| B. | 将50℃时的硝酸钾溶液降温10℃,有晶体析出 | |
| C. | 60℃时,往100g水中加入100g硝酸钾,可得到饱和溶液200g | |
| D. | 欲从海水中获取氯化钠,采用蒸发溶剂的方法 |
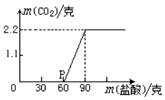 某科学课外活动小组为测定实验室中久置的NaOH的变质程度,先称取17.3克的NaOH样品(杂质为Na2CO3),配成溶液.然后向溶液中逐滴加入质量分数为20%的稀盐酸.根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.回答下列问题
某科学课外活动小组为测定实验室中久置的NaOH的变质程度,先称取17.3克的NaOH样品(杂质为Na2CO3),配成溶液.然后向溶液中逐滴加入质量分数为20%的稀盐酸.根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.回答下列问题