题目内容
4.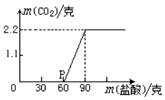 某科学课外活动小组为测定实验室中久置的NaOH的变质程度,先称取17.3克的NaOH样品(杂质为Na2CO3),配成溶液.然后向溶液中逐滴加入质量分数为20%的稀盐酸.根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.回答下列问题
某科学课外活动小组为测定实验室中久置的NaOH的变质程度,先称取17.3克的NaOH样品(杂质为Na2CO3),配成溶液.然后向溶液中逐滴加入质量分数为20%的稀盐酸.根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.回答下列问题(1)实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示.则样品中Na2CO3的质量为5.3克.由此得出保存NaOH时应该密封保存.
(2)计算实验过程中与NaOH反应所用盐酸的质量.
(3)计算所得“与NaOH反应所用盐酸的质量”与图象上的P点数值并不一致,这是由于CO2与碳酸钠、水反应生成碳酸氢钠造成的.
分析 根据在变质的氢氧化钠中滴加盐酸,盐酸与碳酸钠产生二氧化碳气体,根据二氧化碳气体的质量可确定碳酸钠的质量以及碳酸钠消耗盐酸的质量进行解答.
解答 解:(1)由图示可知产生的二氧化碳的质量为2.2g;
设生成2.2g二氧化碳时需要的碳酸钠质量是x,碳酸钠消耗盐酸的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x y×20% 2.2g
$\frac{106}{x}$=$\frac{73}{y×20%}$=$\frac{44}{2.2g}$
x=5.3g
y=18.25g
保存NaOH时应该密封保存;
(2)设实验过程中与NaOH反应所用盐酸的质量为z
NaOH+HCl=NaCl+H2O
40 36.5
12g z×20%
$\frac{40}{12g}$=$\frac{36.5}{z×20%}$
z=54.75g
(3)碳酸钠、水和二氧化碳反应生成碳酸氢钠,所以计算所得“与NaOH反应所用盐酸的质量”与图象上的P点数值并不一致.
故答案为:(1)5.3,密封保存;
(2)54.75g;
(3)与碳酸钠、水反应生成碳酸氢钠.
点评 本题难度较大,主要考查了通过图象分析有价值的数据,然后根据化学方程式进行有关量的计算,培养学生的分析能力和解决问题的能力.

练习册系列答案
相关题目
6.下列实验操作正确的是( )
| A. | 制取蒸馏水时,将温度计玻璃球插入水中 | |
| B. | 过滤时,将玻璃棒靠在三层滤纸的一边 | |
| C. | 在“粗盐中难溶性杂质的去除”实验中,将蒸发皿中的溶液直接蒸干 | |
| D. | 分离硝酸钾和氯化钠组成的混合物-利用硝酸钾和氯化钠分解温度不同 |
12.某样品为铜和氧化铜的混合物,为测定样品中氧化铜的含量,甲、乙、丙、丁四位同学用同一样品分别进行实验,测定的实验数据如下表.请分析数据解答下列问题:
(1)丙同学的实验中,样品中有8g的CuO参加了反应(填名称或化学式);
(2)四位同学中,两位同学所取的硫酸溶液质量不足(从“甲”、“乙”、“丙”或“丁”中选择填写);
(3)计算混合物氧化铜的质量分数;
(4)计算硫酸溶液中溶质的质量分数.
| 甲 | 乙 | 丙 | 丁 | |
| 所取固体样品的质量/g | 25 | 25 | 20 | 20 |
| 加入硫酸溶液的质量/g | 50 | 100 | 100 | 120 |
| 反应剩余固体的质量/g | 21 | 17 | 12 | 12 |
| 反应掉固体的质量/g | 4 | 8 | 8 |
(2)四位同学中,两位同学所取的硫酸溶液质量不足(从“甲”、“乙”、“丙”或“丁”中选择填写);
(3)计算混合物氧化铜的质量分数;
(4)计算硫酸溶液中溶质的质量分数.
19.从如图获取的信息中错误的是( )

| A. | 空气是一种混合物 | B. | 氮气沸点比氧气低 | ||
| C. | 该过程为化学变化 | D. | 氧气由氧分子构成 |
9.建立一个适当的模型来反映和代替客观对象,可以帮助我们认识和理解观察不到的化学反应.如图为某反应的部分微观示意图,其中不同的球代表不同元素的原子.下列说法正确的是( )

| A. | 该反应属于化合反应 | |
| B. | 黑球表示的元素的化合价在反应前后未改变 | |
| C. | 1个X分子中含有3个原子 | |
| D. | 参加反应的两种分子个数比为1:1 |
13.甲、乙两同学在室温下各取50克某溶液分别做制晶体实验,甲将溶液蒸发掉10克水后冷却至室温得晶体4克(晶体不含结晶水),乙将溶液蒸发掉15克水后冷却至室温,得晶体9克.若两人实验结果都正确,则某溶液中溶质的质量分数为( )
| A. | 28.6% | B. | 37.5% | C. | 40% | D. | 44% |
14.小萍查找资料获悉浓硫酸具有很强的吸水性,如果敞口放置它会吸收空气中的水蒸汽;而浓盐酸则有很强的挥发性,如果将之敞口放置则会挥发出盐酸溶液中的溶质氯化氢气体.则下列选项正确的是(均不考虑过程中水的蒸发)( )
| A. | 浓硫酸敞口放置一段时间会变稀,其溶质质量减少 | |
| B. | 浓盐酸敞口放置一段时间会变稀,其溶剂质量增加 | |
| C. | 无论是浓硫酸还是浓盐酸长期放置它们的溶质质量分数都会减少,原因相同 | |
| D. | 浓盐酸敞口放置较长时间后因其溶质质量分数减少而变成了稀盐酸 |
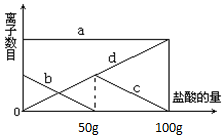 小明同学在实验室中向25g含有不溶于酸的杂质的碳酸钾配置成溶液,溶液中缓慢地滴加10%的稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡,经查询资料后得知,碳酸钾与盐酸反应先生成碳酸氢钾和氯化钾,随着盐酸的加入,碳酸氢钾再和盐酸反应生成氯化钾释放二氧化碳.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线分别与溶液中的四种离子的对应
小明同学在实验室中向25g含有不溶于酸的杂质的碳酸钾配置成溶液,溶液中缓慢地滴加10%的稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡,经查询资料后得知,碳酸钾与盐酸反应先生成碳酸氢钾和氯化钾,随着盐酸的加入,碳酸氢钾再和盐酸反应生成氯化钾释放二氧化碳.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线分别与溶液中的四种离子的对应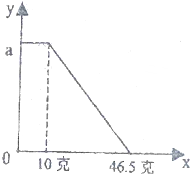 某固体物质由NaOH和MgCl2组成,取一定质量的该混合物溶于水,在所得的悬浊液中逐滴加入溶质质量分数为10%的稀盐酸,发现沉淀的质量(y)与加入盐酸的质量(x)有如图所示的关系,根据此图完成下列问题
某固体物质由NaOH和MgCl2组成,取一定质量的该混合物溶于水,在所得的悬浊液中逐滴加入溶质质量分数为10%的稀盐酸,发现沉淀的质量(y)与加入盐酸的质量(x)有如图所示的关系,根据此图完成下列问题