题目内容
10.人类利用金属矿物历史久远.(1)现代冶炼技术用CO与赤铁矿石反应来冶炼生铁,请写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图所示:

①溶液A中共含有四种阳离子;
②在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀.该实验条件下,使金属阳离子沉淀的相关pH数据见下表.为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为6.7~8.6;
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 4.2 | 8.6 |
| 完全沉淀的pH | 3.2 | 6.7 | 11.1 |
分析 (1)根据炼铁的反应原理写出反应的化学方程式;
(2)根据氧化物与酸反应的性质、盐与碱的反应性质分析判断回答有关的问题.
解答 解:(1)一氧化碳还原氧化铁生成铁和二氧化碳,化学反应式是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)由题意可知,组成矿石的四种氧化物中仅SiO2不与盐酸反应,其余三种均能反应:MgO+2HCl═MgCl2+H2O、Fe2O3+6HCl═2FeCl3+3H2O、CuO+2HCl═CuCl2+H2O,溶液A的pH<1,说明反映后溶液呈强酸性,盐酸过量,因此溶液A中的阳离子有Mg2+、Fe3+、Cu2+、H+;要使Mg(OH)2纯度高、损失少,必须把pH控制在氯化铜能完全沉淀、但氯化镁不能沉淀的范围内,即6.7<pH<8.6的范围内;溶液B中一定有氯化镁和反应生成的氯化钙.
①由上述分析可知,溶液A中共含有Mg2+、Fe3+、Cu2+、H+四种阳离子;
②溶液B的pH可容许的范围为 6.7~8.6;
③溶液B中一定含有的溶质为MgCl2、CaCl2.
故答为:(1)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.(2)①4;②6.7~8.6;③MgCl2、CaCl2.
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.

练习册系列答案
相关题目
1.KNO3与NH4Cl两种物质的溶解度曲线如图所示,下列说法错误的是( )
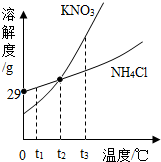

| A. | t1℃时用等质量的固体配制饱和溶液,NH4Cl溶液质量更大 | |
| B. | t2℃时两种饱和溶液中溶质的质量分数一定相等 | |
| C. | t3℃时KNO3的溶解度大于NH4Cl的溶解度 | |
| D. | 两种饱和溶液从t2℃降到t1℃时,均有晶体析出 |
18.化学与生产、生活密不可分,下列有关说法不正确的是( )
| A. | 万一所住楼房失火,应立即开窗通风 | |
| B. | 误食重金属盐可先喝下大量鲜牛奶解毒 | |
| C. | 长期饮用蒸馏水不利于身体健康 | |
| D. | 燃煤使用脱硫技术可减少酸雨的形成 |
8.分子与原子的根本区别是( )
| A. | 大小相同 | |
| B. | 分子可分而原子不可再分 | |
| C. | 是否保持物质的化学性质 | |
| D. | 在化学反应中分子可分而原子不可再分 |