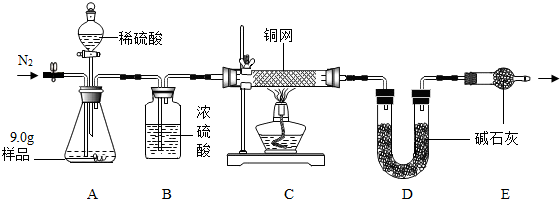
题目内容
18.化学与生产、生活密不可分,下列有关说法不正确的是( )| A. | 万一所住楼房失火,应立即开窗通风 | |
| B. | 误食重金属盐可先喝下大量鲜牛奶解毒 | |
| C. | 长期饮用蒸馏水不利于身体健康 | |
| D. | 燃煤使用脱硫技术可减少酸雨的形成 |
分析 A、根据促进物质燃烧的条件分析解答.
B、根据重金属盐可以使蛋白质变性来分析.
C、根据长期饮用纯净水,无法补充人体所需的微量的矿物质,进行分析判断.
D、根据燃煤脱硫后可以防止二氧化硫的产生进行分析判断.
解答 解:A、室内着火不应立即开窗通风,因为通风会进入更多的氧气,使燃烧更旺,故A错误,
B、重金属盐可以是蛋白质变性,所以误食后会中毒,服用大量的牛奶后,可以和重金属反应,变为不被吸收的物质,减弱对肠胃的影响,故B正确,
C、长期饮用纯净水,无法补充人体所需的微量的矿物质,不宜于身体健康,故C正确.
D、使用燃煤脱硫技术,减少酸雨的产生,故D正确.
故选A.
点评 化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
9.小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究.如表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
(1)写出铝和盐酸反应的化学方程式:2Al+6HCl=2AlCl3+3H2↑.
(2)能表明盐酸浓度对反应快慢有影响的实验编号是:①和②.
(3)如果把实验①中盐酸的质量分数改为4.5%,请你推出铝丝消失时间(用t表示)的取值范围:300<t<500.
(4)除了用铝丝消失的时间,请你再想一个方法来衡量该反应的快慢:用排水法收集一瓶氢气所需时间的多少来衡量(或通过单位时间内生成氢气的量、温度变化来衡量等,其他合理答案均可).
| 试验编号 | 盐酸的质量分数/% | 反应温度 | 铝丝消失时间/s |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
(2)能表明盐酸浓度对反应快慢有影响的实验编号是:①和②.
(3)如果把实验①中盐酸的质量分数改为4.5%,请你推出铝丝消失时间(用t表示)的取值范围:300<t<500.
(4)除了用铝丝消失的时间,请你再想一个方法来衡量该反应的快慢:用排水法收集一瓶氢气所需时间的多少来衡量(或通过单位时间内生成氢气的量、温度变化来衡量等,其他合理答案均可).
6.节能减排,保护环境,是我们共同点责任.下列做法与此倡导不相符的是( )
| A. | 家庭中,提倡垃圾分离 | B. | 工作中,采取无纸化办公 | ||
| C. | 工业上,回收废旧金属再利用 | D. | 交通上,拓宽马路,鼓励私家车出行 |
3.将含有杂质的金属样品加入到70g7%的稀硫酸中,恰好完全反应(杂质不跟稀硫酸反应),在反应后得到的硫酸盐中,金属元素的质量分数为20%,则在该金属样品中,和稀硫酸反应的金属单质的质量是( )
| A. | 1.5g | B. | 1.3g | C. | 2.0g | D. | 1.2g |
10.人类利用金属矿物历史久远.
(1)现代冶炼技术用CO与赤铁矿石反应来冶炼生铁,请写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图所示:
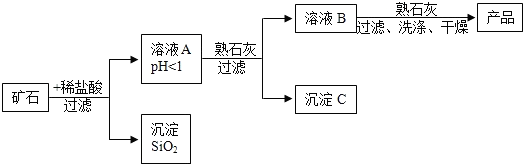
①溶液A中共含有四种阳离子;
②在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀.该实验条件下,使金属阳离子沉淀的相关pH数据见下表.为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为6.7~8.6;
③溶液B中一定含有的溶质为MgCl2、CaCl2(填化学式).
(1)现代冶炼技术用CO与赤铁矿石反应来冶炼生铁,请写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图所示:

①溶液A中共含有四种阳离子;
②在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀.该实验条件下,使金属阳离子沉淀的相关pH数据见下表.为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为6.7~8.6;
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 4.2 | 8.6 |
| 完全沉淀的pH | 3.2 | 6.7 | 11.1 |
15.工业上常利石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3和超细CaCO3.
Ⅰ.制备KClO3的流程如图:

已知:①反应1为:6Cl2+6Ca(OH)2═Ca(ClO3)2+5CaCl2+6H2O.
②有关物质在常温下的溶解度如表:
(1)操作a的名称是过滤,在实验室中完成此操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,该操作中玻璃棒的作用是引流.
(2)反应2为复分解反应,则溶液A中含有的溶质为CaCl2和KClO3(填化学式),你认为该反应能得到KClO3晶体的原因是氯酸钾在该温度下的溶解度小.
(3)洗涤KClO3晶体时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图已知NH4Cl溶液呈酸性.
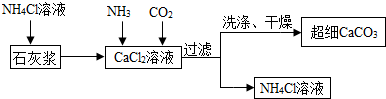
(1)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.该流程可循环使用的物质是NH4Cl.
(2)检验CaCO3是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加AB(填写序号),观察,根据实验现象推断是否洗干净.
A.Na2CO3溶液 B.AgNO3溶液 C.酚酞试液.
Ⅰ.制备KClO3的流程如图:

已知:①反应1为:6Cl2+6Ca(OH)2═Ca(ClO3)2+5CaCl2+6H2O.
②有关物质在常温下的溶解度如表:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(2)反应2为复分解反应,则溶液A中含有的溶质为CaCl2和KClO3(填化学式),你认为该反应能得到KClO3晶体的原因是氯酸钾在该温度下的溶解度小.
(3)洗涤KClO3晶体时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图已知NH4Cl溶液呈酸性.

(1)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.该流程可循环使用的物质是NH4Cl.
(2)检验CaCO3是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加AB(填写序号),观察,根据实验现象推断是否洗干净.
A.Na2CO3溶液 B.AgNO3溶液 C.酚酞试液.
 A、B、C、D、E、F均为初中化学中常见的物质,E俗称纯碱,它们之间存在如图的转化关系.“→”表示物质间存在着相应的转化关系,“-”表示物质间能发生反应(部分反应物、生成物和反应条件未标出).
A、B、C、D、E、F均为初中化学中常见的物质,E俗称纯碱,它们之间存在如图的转化关系.“→”表示物质间存在着相应的转化关系,“-”表示物质间能发生反应(部分反应物、生成物和反应条件未标出).