题目内容
10.纳米碳酸钡是一种重要的无机化工产品,下图是某厂生产纳米碳酸钡的工艺流程.请回答下列问题: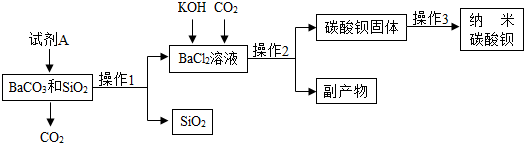
(1)加入试剂A所发生反应的化学方程式有BaCO3+2HCl=BaCl2+H2O+CO2↑.
(2)向BaCl2溶液中加入KOH、通入CO2发生反应的化学方程式有2KOH+CO2=K2CO3+H2O、BaCl2+K2CO3=BaCO3↓+2KCl.操作3为洗涤、检验和干燥,洗涤的作用是除去固体表面的KCl杂质,检验洗涤是否干净可选用试剂AgNO3(写化学式).
(3)某同学查阅资料得知,二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠(Na2SiO3),该反应的化学方程式2NaOH+SiO2=Na2SiO3+H2O.根据此原理该同学设计出如下方案制备:取碳酸钡和二氧化硅混合物,滴加过量的NaOH溶液,过滤,洗涤,烘干得碳酸钡固体.
分析 (1)碳酸钡能与稀盐酸反应生成氯化钡、水、二氧化碳,根据操作1后得到氯化钡溶液,可推断向混合物中所加的试剂A可为稀盐酸;
(2)根据氢氧化钾能与二氧化碳反应生成碳酸钾和水,碳酸钾能与氯化钡反应生成碳酸钡沉淀解答;根据物质的提纯方法,为从反应后的混合溶液中分离出碳酸钡固体,应通过过滤、洗涤与烘干操作,并根据氯化钾与硝酸银可产生白色氯化银沉淀,可采取滴加硝酸银的方法检验洗涤干净;
(3)利用非金属氧化物与碱溶液的反应规律,判断二氧化硅与氢氧化钠的反应,写出反应的化学方程式;并结合除杂的操作方法,判断过程中加入氢氧化钠的量.
解答 解:(1)根据反应后生成氯化钡,由碳酸钡能与盐酸反应生成氯化钡、水、二氧化碳,可判断所加入的试剂A应为稀盐酸,故反应是碳酸钡和稀盐酸的反应;
(2)氢氧化钾能与二氧化碳反应生成碳酸钾和水,碳酸钾能与氯化钡反应生成碳酸钡沉淀;为从反应后的混合溶液中获得纯净碳酸钡,需要进行过滤,过滤后洗涤沉淀表面残留的溶液,以除去沉淀表面可溶性杂质或残留滤渣表面滤液,然后进行烘干干燥;为检验洗涤干净,利用氯化钾能与硝酸银产生白色沉淀,可向洗涤后的溶液中滴加硝酸银检验洗涤后的溶液中不再含有氯化钾,以证明洗涤干净;
(3)二氧化硅为非金属氧化物,根据这两类物质的反应特点,可知反应生成硅酸钠和水,反应的化学方程式为2NaOH+SiO2══Na2SiO3+H2O;为除去碳酸钡与二氧化硅中的二氧化硅,利用二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠,可向混合物中加入过量氢氧化钠溶液以完全除去二氧化硅,经过过滤,洗涤,烘干得碳酸钡固体.
故答案为:
(1)BaCO3+2HCl=BaCl2+H2O+CO2↑;
(2)2KOH+CO2=K2CO3+H2O;BaCl2+K2CO3=BaCO3↓+2KCl;干燥; 除去固体表面的KCl杂质;AgNO3;
(3)2NaOH+SiO2=Na2SiO3+H2O;NaOH.
点评 通过流程图的分析,明确生产过程中所涉及的物质性质及变化规律,体现运用知识分析问题、解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 制造药匙的不锈钢属于混合物 | |
| B. | 制造蒸发皿的陶瓷主要成分是硅酸鈣(CaSiO3),硅酸钙属于盐 | |
| C. | 制造棕色试剂瓶的玻璃,其主要成分为二氧化硅,玻璃属于化合物 | |
| D. | 火柴头覆盖的红色物质为红磷,红磷属于单质 |
(1)现代冶炼技术用CO与赤铁矿石反应来冶炼生铁,请写出该反应的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图所示:

①溶液A中共含有四种阳离子;
②在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀.该实验条件下,使金属阳离子沉淀的相关pH数据见下表.为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为6.7~8.6;
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 4.2 | 8.6 |
| 完全沉淀的pH | 3.2 | 6.7 | 11.1 |
Ⅰ.制备KClO3的流程如图:

已知:①反应1为:6Cl2+6Ca(OH)2═Ca(ClO3)2+5CaCl2+6H2O.
②有关物质在常温下的溶解度如表:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(2)反应2为复分解反应,则溶液A中含有的溶质为CaCl2和KClO3(填化学式),你认为该反应能得到KClO3晶体的原因是氯酸钾在该温度下的溶解度小.
(3)洗涤KClO3晶体时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如图已知NH4Cl溶液呈酸性.
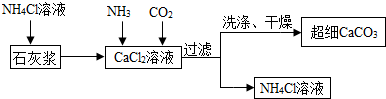
(1)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.该流程可循环使用的物质是NH4Cl.
(2)检验CaCO3是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加AB(填写序号),观察,根据实验现象推断是否洗干净.
A.Na2CO3溶液 B.AgNO3溶液 C.酚酞试液.
| A. | 不慎将水银温度计打碎洒落在桌面上,立即扫入垃圾桶中 | |
| B. | 不慎将酒精灯碰倒,洒出的酒精在桌上燃烧起来,立刻用湿布扑灭 | |
| C. | 不慎将浓硫酸沾到皮肤上,立刻用大量水冲洗,再涂上3%一5%碳酸氢钠溶液 | |
| D. | 不慎将氢氧化钠溶液沾到皮肤上,立刻用大量水冲洗,再涂上硼酸溶液 |


 科学严谨的态度,安全规范的操作是成功进行化学实验的保障.
科学严谨的态度,安全规范的操作是成功进行化学实验的保障.


