题目内容
14.完成下列变化的化学方程式,并按要求填空.(1)镁条在空气中燃烧2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,点燃镁条时使用的夹持仪器是坩埚钳
(2)实猃室用6%的过氧化氢溶液与二氧化锰混合制氧气2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,6%的过氧化氢溶液中氢元素的质量分数为10.8%.(计算结果精确到0.1%)
(3)氨水与硫酸反应2NH3•H2O+H2SO4═(NH4)2SO4+2H2O,生成的盐可用作氮肥(填写化肥种类).
(4)一氧化碳在高温下与氧化铁反应Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,反应前后气体的化学计量数之比为1:1.
(5)受到猛烈撞击时,硝酸铵会迅速分解生成一氧化二氮气体和另一种氧化物NH4NO3$\frac{\underline{\;撞击\;}}{\;}$N2O+2H2O,一氧化二氮中氮元素的化合价为+1.
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)镁燃烧生成氧化镁,加持镁条的仪器是坩埚钳,故填:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;坩埚钳;
(2)过氧化氢溶液与二氧化锰混合生成水和氧气,设过氧化氢溶液的质量为100,故6%的过氧化氢溶液中氢元素的质量分数为:$\frac{100g×6%×\frac{1×2}{34}+(100g-100g×6%)×\frac{1×2}{18}}{100g}$×100%≈10.8%,故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;10.8%;
(3)氨水与硫酸反应生成硫酸铵和水,生成的硫酸铵能作氮肥使用,故填:2NH3•H2O+H2SO4═(NH4)2SO4+2H2O;氮;
(4)一氧化碳与氧化铁高温反应生成铁和二氧化碳,一氧化碳和二氧化碳的化学计量数之比为1:1,故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;1:1;
(5)硝酸铵受到撞击会迅速分解生成一氧化二氮气体和水,一氧化二氮中氮元素的化合价为+1,故填:NH4NO3$\frac{\underline{\;撞击\;}}{\;}$N2O+2H2O;+1.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
19.锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水分得到固体硫酸锌、硫酸铝、硫酸镁混合物11g,则反应中生成氢气的质量为( )
| A. | 0.30g | B. | 0.20g | C. | 0.15g | D. | 0.45g |
7.某研究小组对自动充气气球(示意图如图1)进行下列探究.
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称)、
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”)、
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
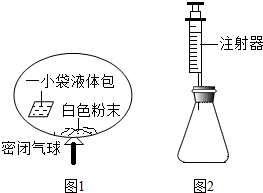
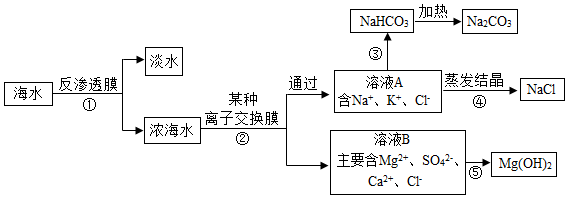
实验①的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;表中x=0.1;V1 >V2(填“>”、“<”或“=”)、
[分析并得出结论]
(5)白色粉末是碳酸氢钠、
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称)、
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”)、
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:

| 实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
| 名称 | 质量/g | ||
| ① | 碳酸氢钠 | 0、10 | V1 |
| ② | 碳酸钠 | 0、10 | V2 |
| ③ | 白色粉末 | x | V1 |
[分析并得出结论]
(5)白色粉末是碳酸氢钠、
 如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.
如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.