题目内容
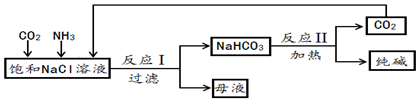
8.纯碱在工业上有广泛的应用.实验室模拟工业上利用饱和食盐水生产纯碱的流程图(图1)是:
回答下列问题:
(1)反应 1 的化学方程式为NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl.
(2)操作 1 中,需要用到的玻璃仪器除漏斗、玻璃棒外,还有烧杯.
(3)纯碱的化学式为Na2CO3,X的化学式为H2O.
(4)“后续处理”主要包括蒸发浓缩、降温结晶、过滤等操作,参考图2的溶解度曲线分析,采用这些操作方法的原因是NH4Cl的溶解度随温度的降低而减小.
(5)写出 NH4Cl 的一种用途用作氮肥.
分析 (1)反应1中,氯化钠和水、氨气、二氧化碳反应生成碳酸氢钠和氯化铵;
(2)操作1是过滤,过滤需要用到的玻璃仪器除漏斗、玻璃棒外,还有烧杯;
(3)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
(4)“后续处理”主要包括蒸发浓缩、降温结晶、过滤等操作,采用这些操作方法的原因是NH4Cl的溶解度随温度的降低而减小;
(5)NH4Cl中含有氮元素,在农业上可以用作氮肥.
解答 解:(1)反应1中,氯化钠和水、氨气、二氧化碳反应生成碳酸氢钠和氯化铵,反应的化学方程式为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl.
故填:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl.
(2)操作1是过滤,过滤需要用到的玻璃仪器除漏斗、玻璃棒外,还有烧杯.
故填:烧杯.
(3)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,因此纯碱的化学式为Na2CO3,X的化学式为H2O.
故填:Na2CO3;H2O.
(4)“后续处理”主要包括蒸发浓缩、降温结晶、过滤等操作,采用这些操作方法的原因是NH4Cl的溶解度随温度的降低而减小.
故填:降温结晶;NH4Cl的溶解度随温度的降低而减小.
(5)NH4Cl中含有氮元素,在农业上可以用作氮肥.
故填:用作氮肥.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
1.液态水蒸发后变成了水蒸气,下列模型能代表这一过程的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
16.下列说法正确的是( )
| A. | pH等于8的溶液一定是碱的溶液 | |
| B. | 不饱和溶液变为饱和溶液溶质质量分数一定变大 | |
| C. | 所有的酸与活泼金属反应一定能生成氢气 | |
| D. | 金属与酸溶液发生置换反应时,生成的溶液质量一定大于原来酸溶液的质量 |
3.下列实验现象描述正确的是( )
| A. | 把氢氧化镁加入到无色的酚酞试液中,试液变成红色 | |
| B. | 打开浓盐酸的试剂瓶的瓶盖,瓶口会有白雾出现 | |
| C. | 氧化铁和稀硫酸反应,最后得到浅绿色溶液 | |
| D. | 铜片放入硝酸银溶液中,溶液会由蓝色逐渐变为无色 |
18.质量分数不同的硫酸溶液其密度不相同,对照表如下:
(1)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是质量分数越大密度越大.
(2)质量分数80%和20%的两种硫酸溶液等体积混合后,溶液中溶质的质量分数是56.2%.(结果保留一位小数)
(3)欲配制300克溶质的质量分数为30%的稀硫酸,需要溶质的质量分数为90%的浓硫酸多少克?水多少克?
| 质量分数 | 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 98% |
| 密度(g/mL) | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.80 | 1.84 |
(2)质量分数80%和20%的两种硫酸溶液等体积混合后,溶液中溶质的质量分数是56.2%.(结果保留一位小数)
(3)欲配制300克溶质的质量分数为30%的稀硫酸,需要溶质的质量分数为90%的浓硫酸多少克?水多少克?