题目内容
2.一些厂家为了使生产出来的米线更白净、更筋道,在米线中添加一些名为焦亚硫酸钠(化学式:Na2S2O5)的食品添加剂,若长期食用,对人体危害很大,请计算:(1)焦亚硫酸钠的相对分子质量为350;
(2)焦亚硫酸钠中硫、氧两种元素的质量比为14:5.
分析 (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
解答 解:(1)焦亚硫酸钠的对分子质量为23×2+32×7+16×5=350.故填:350;
(2)焦亚硫酸钠中S、O两种元素的质量比为(32×7):(16×5)=14:5.故填:14:5.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12. 2017年5月29日,端午前夜的松花江畔人声鼎沸,摩肩接踵,一年一度的端午佳节在人们踏青的脚步声中拉开了帷幕!下列叙述不正确的是( )
2017年5月29日,端午前夜的松花江畔人声鼎沸,摩肩接踵,一年一度的端午佳节在人们踏青的脚步声中拉开了帷幕!下列叙述不正确的是( )
 2017年5月29日,端午前夜的松花江畔人声鼎沸,摩肩接踵,一年一度的端午佳节在人们踏青的脚步声中拉开了帷幕!下列叙述不正确的是( )
2017年5月29日,端午前夜的松花江畔人声鼎沸,摩肩接踵,一年一度的端午佳节在人们踏青的脚步声中拉开了帷幕!下列叙述不正确的是( )| A. | 端午节吃到美味的粽子,离不开化学发挥的重要作用 | |
| B. | 霓虹灯内充有氧气,通电后才能发出绚丽夺目的光芒 | |
| C. | 松花江水中含有难溶性和可溶性的杂质,属于混合物 | |
| D. | 人们踏青时,应该将垃圾扔进垃圾桶,积极保护环境 |
4.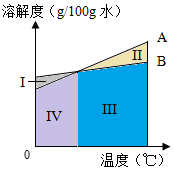 “侯氏制碱法”的生产原理是:先将氨气通入饱和食盐水中,再将压缩的二氧化碳通入饱和的氨盐水,得到碳酸氢钠晶体,分离得到的碳酸氢钠晶体充分受热分解后即可制得纯碱.
“侯氏制碱法”的生产原理是:先将氨气通入饱和食盐水中,再将压缩的二氧化碳通入饱和的氨盐水,得到碳酸氢钠晶体,分离得到的碳酸氢钠晶体充分受热分解后即可制得纯碱.
NaCl和NH4Cl的溶解度表:
请根据提供的信息,回答问题:
①10℃时,NaCl的溶解度是35.8g;
②图中,表示NH4Cl的溶解度曲线是A(填“A”或“B”)
③常温20℃时,配制的饱和食盐水的质量分数为26.5%,将食盐水的温度提高,溶液中溶质的质量分数也将提高,而实际生产中往往在常温下进行,这样做的理由是温度升高食盐的溶解度升高不多,因此质量分数也提高不多,而耗能大;
④若NaCl和NH4Cl溶液溶质质量分数相同,表示其溶液状态的点在图中可能位于的区域是I、II、III、IV(选填 I、II、III、IV);
⑤生产中通入氨气及二氧化碳,若要提高这些气体的溶解度,下列做法可行的是A(选填编号)
A.增大压强 B.升高温度 C.增加水量.
 “侯氏制碱法”的生产原理是:先将氨气通入饱和食盐水中,再将压缩的二氧化碳通入饱和的氨盐水,得到碳酸氢钠晶体,分离得到的碳酸氢钠晶体充分受热分解后即可制得纯碱.
“侯氏制碱法”的生产原理是:先将氨气通入饱和食盐水中,再将压缩的二氧化碳通入饱和的氨盐水,得到碳酸氢钠晶体,分离得到的碳酸氢钠晶体充分受热分解后即可制得纯碱.NaCl和NH4Cl的溶解度表:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | |
| 溶解度 (g/100g水) | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | |
①10℃时,NaCl的溶解度是35.8g;
②图中,表示NH4Cl的溶解度曲线是A(填“A”或“B”)
③常温20℃时,配制的饱和食盐水的质量分数为26.5%,将食盐水的温度提高,溶液中溶质的质量分数也将提高,而实际生产中往往在常温下进行,这样做的理由是温度升高食盐的溶解度升高不多,因此质量分数也提高不多,而耗能大;
④若NaCl和NH4Cl溶液溶质质量分数相同,表示其溶液状态的点在图中可能位于的区域是I、II、III、IV(选填 I、II、III、IV);
⑤生产中通入氨气及二氧化碳,若要提高这些气体的溶解度,下列做法可行的是A(选填编号)
A.增大压强 B.升高温度 C.增加水量.
11.鸡蛋壳的主要成分是为碳酸钙(其他成分不溶于水也不与酸反应),为测定鸡蛋壳中碳酸钙的质量分数,兴趣小组同学取12.5g鸡蛋壳,把120g稀盐酸分6次加入到鸡蛋壳中,测得生成气体与加入稀盐酸的数据如表:
回答下列问题
(1)表中a=1.76;当加入120g稀盐酸时溶液的pH<7 (选填“>”、“<”或“=”).
(2)碳酸钙中各元素的质量比为:钙:碳:氧=10:3:12(填最简比).
(3)通过计算求出鸡蛋壳中碳酸钙的质量分数(写出计算过程).
| 加入盐酸质量(g) | 20 | 40 | 60 | 80 | 100 | 120 |
| 收集的气体质量(g) | 0.88 | a | 2.64 | 3.52 | 4.4 | 4.4 |
(1)表中a=1.76;当加入120g稀盐酸时溶液的pH<7 (选填“>”、“<”或“=”).
(2)碳酸钙中各元素的质量比为:钙:碳:氧=10:3:12(填最简比).
(3)通过计算求出鸡蛋壳中碳酸钙的质量分数(写出计算过程).
