题目内容
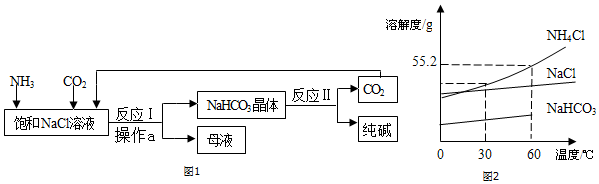
20.(1)我国著名化工专家侯德榜先生发明了“侯氏制碱法”为我国民族工业的发展做出了杰出贡献,“NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl“是侯氏制碱法的重要反应之一,下列有关说法错误的是C(填序号).A、向饱和食盐水中先通入氨气,使溶液呈碱性,更易吸收酸性的CO2气体
B、反应后,NaHCO3首先结晶析出,过滤即可将其分离出来
C、NaHCO3结晶析出后,剩余溶液中的溶质只有NH4Cl
D、NaHCO3结晶析出后,剩余溶液还能继续溶解NaCl固体
(2)海洋是巨大的资源宝库,我们可利用海水为原料制取大量的重要化工产品,例如:海水中存在大量的氯化钠,电解纯净的氯化钠溶液可以制得氢气、氯气和物质A,其反应原理为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2A+Cl2↑+H2↑,试推断A的化学式为NaOH.
(3)t1℃时,将a、b两种固体各18g分别加入到盛有100g水的烧杯中,充分搅拌后实验现象如甲图所示,升温到t2℃时,实验现象如乙图所示,a、b两种固体在水中的溶解度曲线如丙图所示.

请根据如图实验现象及溶解度曲线填空:
①从t1℃到t2℃的变化过程中,一直处于饱和状态的是b(填“a”或“b”)溶液.
②丙图中,曲线M表示的是a(填“a”或“b”)的溶解度曲线.
③若a中混有少量b,可采用降温结晶的方法提纯a.(填“蒸发结晶”或“降温结晶”).
分析 (1)氨盐水显碱性,容易吸收二氧化碳;
过滤能够把固体和液体分离;
NaHCO3结晶析出后,剩余溶液仍然是碳酸氢钠的饱和溶液;
反应后氯化钠被消耗,剩余溶液是氯化钠的不饱和溶液;
(2)化学反应遵循质量守恒定律,即反应前后元素种类不变,原子种类、总个数都不变;
(3)根据实验过程及其物质的溶解度曲线可以判断相关方面的问题.
解答 解:(1)A、向饱和食盐水中先通入氨气,使溶液呈碱性,更易吸收酸性的CO2气体,该选项说法正确;
B、反应后,NaHCO3首先结晶析出,过滤即可将其分离出来,该选项说法正确;
C、NaHCO3结晶析出后,剩余溶液中的溶质至少有碳酸氢钠和氯化铵,该选项说法不正确;
D、反应后氯化钠被消耗,剩余溶液是氯化钠的不饱和溶液,剩余溶液还能继续溶解NaCl固体,该选项说法正确.
故选:C.
(2)由2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2A+Cl2↑+H2↑可知,反应前后氯原子都是2个,反应前钠原子是2个,反应后应该是2个,包含在2A中,反应前氢原子是4个,反应后应该是4个,其中2个包含在2A中,反应前氧原子是2个,反应后应该是2个,包含在2A中,因此A的化学式为NaOH.
故填:NaOH.
(3)①从t1℃到t2℃的变化过程中,一直处于饱和状态的是b溶液,这是因为b中始终由未溶解的固体.
故填:b.
②丙图中,曲线M表示的是a的溶解度曲线,这是因为随着温度升高,a中固体消失,说明a的溶解度随着温度升高而增大.
③若a中混有少量b,可采用降温结晶的方法提纯a.
故填:降温结晶.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
11.鸡蛋壳的主要成分是为碳酸钙(其他成分不溶于水也不与酸反应),为测定鸡蛋壳中碳酸钙的质量分数,兴趣小组同学取12.5g鸡蛋壳,把120g稀盐酸分6次加入到鸡蛋壳中,测得生成气体与加入稀盐酸的数据如表:
回答下列问题
(1)表中a=1.76;当加入120g稀盐酸时溶液的pH<7 (选填“>”、“<”或“=”).
(2)碳酸钙中各元素的质量比为:钙:碳:氧=10:3:12(填最简比).
(3)通过计算求出鸡蛋壳中碳酸钙的质量分数(写出计算过程).
| 加入盐酸质量(g) | 20 | 40 | 60 | 80 | 100 | 120 |
| 收集的气体质量(g) | 0.88 | a | 2.64 | 3.52 | 4.4 | 4.4 |
(1)表中a=1.76;当加入120g稀盐酸时溶液的pH<7 (选填“>”、“<”或“=”).
(2)碳酸钙中各元素的质量比为:钙:碳:氧=10:3:12(填最简比).
(3)通过计算求出鸡蛋壳中碳酸钙的质量分数(写出计算过程).
15.下列说法中正确的是( )
| A. | 红磷在氧气中能燃烧,在空气中不能燃烧 | |
| B. | 铁丝在空气中燃烧时,火星四射,生成黑色固体 | |
| C. | 硫在氧气中燃烧后生成有刺激性气味的气体 | |
| D. | 木炭伸入盛有氧气的集气瓶中剧烈燃烧,发出白光 |
12.下列物质属于氧化物的是( )
| A. | SiO2 | B. | NaCl | C. | O3 | D. | KClO3 |