题目内容
2.在实验室某实验小组将一些铁粉加入到硫酸铜溶液溶液中,发现不但有红色固体析出,而且有较多的气泡产生.(一) 请你写出析出红色固体的化学方程式Fe+CuSO4═FeSO4+Cu;反应过程中,溶液中铜元素的质量将减小 (选填“增大”、“减小”或“不变”)
(二) 为确定气体的成分,请你参与下列实验探究.
【提出猜想】从物质组成元素角度分析,气体可能是SO2、O2、H2中的一种或几种.
【进行实验】(1)甲同学为确定是否含有SO2,他将气体通入酸性高锰酸钾溶液中,溶液颜色未发生变化,则该气体中无SO2(填“有”或“无”).
(2)乙同学认为只有O2,则可用带火星的木条来检验.实验证明乙同学的观点不正确
【提出问题】丙同学想通过实验判断是否含有O2,同时确定气体成分.
【查阅资料】得知:O2+4KI+4HCl=2I2+4KCl+2H2O,I2为碘单质.
【继续进行实验】于是他设计了如图所示的实验装置:

【实验现象与结论】A中观察到溶液不变色(或溶液不变蓝色),证明无O2;B中观察到铜网表面变红,证明该气体是H2.
【反思与交流】(1)大家认为丙同学在加热之前,应对气体先验纯以确保安全.
(2)由上述实验可知,硫酸铜溶液显酸性(填“酸”或“碱”).
分析 (一)铁能与硫酸铜反应生成硫酸亚铁和铜,根据质量守恒定律解答;
(二)根据二氧化硫能使高锰酸钾溶液褪色解答;
【实验现象与结论】根据题中信息及淀粉遇碘变蓝解答;根据氧化铜与氢气反应生成铜解答;
【反思与交流】(1)根据可燃性气体点燃易发生爆炸解答;
(2)根据物质的性质进一步进行推测解答即可.
解答 解:
(一)铁能与硫酸铜反应生成硫酸亚铁和铜,故填:CuSO4+Fe=FeSO4+Cu;反应过程中,溶液中铜元素的质量将减小;
(二)同学为确定是否含有SO2,他将气体通入酸性高锰酸钾溶液中,溶液颜色未发生变化,则该气体中无SO2.
【实验现象与结论】
有题意可知:O2+4KI+4HCl=2I2+4KCl+2H2O,淀粉遇碘变蓝,如果A中观察到液不变色(或溶液不变蓝色),证明无O2;氧化铜与氢气反应生成铜,如果B中观察到铜网表面变红,证明该气体是H2.
【反思与交流】(1)大家认为丙同学在加热之前,应对气体先验纯 以确保安全.
(2)硫酸铜溶液能与铁反应生成氢气,说明硫酸铜溶液呈酸性;
答案:
(一) Fe+CuSO4═FeSO4+Cu; 减小;
(二)【进行实验】(1)无; (2)带火星的木条;
【实验现象与结论】溶液不变色(或溶液不变蓝色); 铜网表面变红;
【反思与交流】(1)验纯; (2)酸.
点评 本题考查的是物质的成分的实验探究,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
13.食品安全日益受到人们关注.下列食品能食用的是( )
| A. | 甲醛浸泡的海产品 | |
| B. | 霉变的大米、花生 | |
| C. | 用亚硝酸钠(NaNO2)代替食盐烹调的食品 | |
| D. | 食盐腌制的咸鸭蛋 |
18.如图所示实验能达到目的是( )
| A. |  验证可燃物燃烧的条件 | B. |  检验化肥是否是铵态氮肥 | ||
| C. |  检验未知物中存在CO32- | D. |  证明CO2能与水反应 |
14. 如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )
如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )
 如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )
如图A~H是初中化学常见的物质.A、B为组成元素相同的无色液体,D、E、F、H是四种不同类别的物质,且均含有地壳中含量第三的元素,其中H可用于治疗胃酸过多;四个虚线圈中的反应各属于四个不同的基本反应类型.图中“──”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.下列说法错误的是( )| A. | 物质C具有助燃性 | B. | 物质G的浓溶液一定具有挥发性 | ||
| C. | E→F的反应可能会产生大量气泡 | D. | H─G的反应为复分解反应 |
12.Ⅰ.下列是实验室制取气体的一些装置图,请根据要求回答:
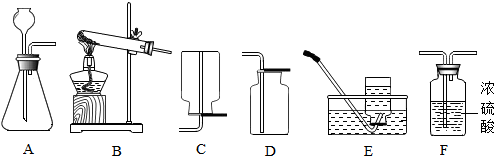
(1)实验室用高锰酸钾做原料制氧气的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;可选用的发生装置是B(填字母序号).
(2)实验室制取并收集一瓶干燥的二氧化碳气体,化学反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.按照气流自左至右方向流动,所用仪器按连接顺序依次为AFD(填字母顺序).
(3)实验室若用5%的过氧化氢溶液与二氧化锰混合来制取氧气.要配制5%的过氧化氢溶液600g,需要质量分数为30%的过氧化氢溶液(密度为1.1g/cm3)90.9mL(计算结果保留一位小数).稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签.
Ⅱ.下列是某化学小组探究物质组成与性质的实验装置图,根据要求回答:
(l)上述实验设计中有错误的是AB(填字母序号);A中可燃物应取过量的原因是可将装置中的氧气耗尽.
(2)B中玻璃棒的作用是搅拌,使产生的热量迅速扩散(加快散热);C中会出现的实验现象为铁钉生锈,U型管液面左高右低.
(3)D中硬质玻璃管内发生反应的化学方程式为3CO+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,酒精灯的作用是点燃尾气中的CO,防止污染环境.

(1)实验室用高锰酸钾做原料制氧气的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;可选用的发生装置是B(填字母序号).
(2)实验室制取并收集一瓶干燥的二氧化碳气体,化学反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.按照气流自左至右方向流动,所用仪器按连接顺序依次为AFD(填字母顺序).
(3)实验室若用5%的过氧化氢溶液与二氧化锰混合来制取氧气.要配制5%的过氧化氢溶液600g,需要质量分数为30%的过氧化氢溶液(密度为1.1g/cm3)90.9mL(计算结果保留一位小数).稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签.
Ⅱ.下列是某化学小组探究物质组成与性质的实验装置图,根据要求回答:
| A | B | C | D |
| 测定空气中氧气的含量 | 稀释浓硫酸 | 铁钉在空气中的变化 | 一氧化碳还原氧化铁 |
木炭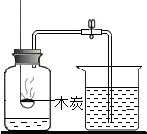 | 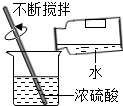 | 水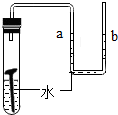 | 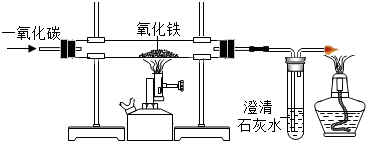 |
(2)B中玻璃棒的作用是搅拌,使产生的热量迅速扩散(加快散热);C中会出现的实验现象为铁钉生锈,U型管液面左高右低.
(3)D中硬质玻璃管内发生反应的化学方程式为3CO+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,酒精灯的作用是点燃尾气中的CO,防止污染环境.
 在哈尔滨市继今年1月份5台纯电动公交车上道试运营后,近日两台插电式气电混合动力公交车也在公交8路、107路上线试运营.插电式混合动力公交车车速23公里/小时以下,为纯电力驱动;速度超过23公里/小时,为气电混合驱动.按照测算,与常规天然气公交车相比,氮氧化物排放量可减少76%、二氧化碳排放量可减少60%,PM排放量可减少86%.回答下列问题.
在哈尔滨市继今年1月份5台纯电动公交车上道试运营后,近日两台插电式气电混合动力公交车也在公交8路、107路上线试运营.插电式混合动力公交车车速23公里/小时以下,为纯电力驱动;速度超过23公里/小时,为气电混合驱动.按照测算,与常规天然气公交车相比,氮氧化物排放量可减少76%、二氧化碳排放量可减少60%,PM排放量可减少86%.回答下列问题.
