题目内容
3.目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础.(一)铁的广泛应用
某品牌的麦片中含微量铁粉,食用后可在胃酸的作用下转化为人体可吸收的铁元素,反应的化学方程式为Fe+2HCl═FeCl2+H2↑.
(二)铁锈成分的探究
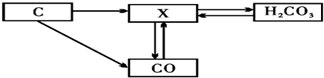
(1)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是C(选填序号).

(2)铁生锈的主要过程为:Fe $\stackrel{O_{2}、H_{2}O}{→}$ Fe(OH)2 $\stackrel{O_{2}、H_{2}O}{→}$ Fe(OH)3 $\stackrel{风吹日晒}{→}$Fe2O3•xH2O
次要过程为:Fe$\stackrel{O_{2}、CO_{2}、H_{2}O}{→}$ FeCO3
写出Fe→Fe(OH)2反应的化学方程式2Fe+O2+2H2O=2Fe(OH)2.
(3)铁锈组成成分的确定
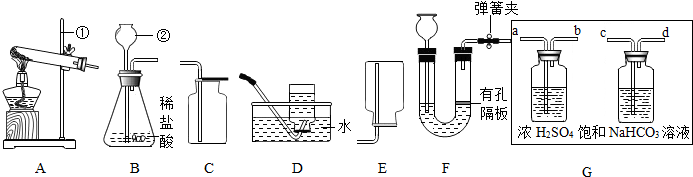
某铁锈成分为Fe2O3•xH2O和FeCO3.为确定其组成,兴趣小组称取此铁锈样品25.4g,在科研人员的指导下用如图装置进行实验.
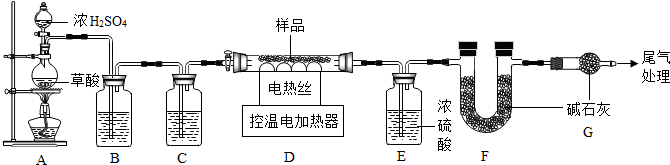
【查阅资料】①Fe2O3•xH2O失去结晶水温度为110℃,FeCO3在282℃分解为FeO和CO2.②温度高于500℃时铁的氧化物才能被CO还原.③碱石灰的主要成分是氢氧化钠和氧化钙.
①装配好实验装置后,首先要检查装置气密性.
②装置A中的反应为:H2C2O4(草酸)CO↑+CO2↑+H2O.通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放c(选填序号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
③现控制D装置中的温度为300℃对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重3.6g,装置F增重2.2g.
则样品中FeCO3的质量m(FeCO3)=5.8g,x=2.
④若缺少G装置,测得的m(FeCO3)偏大(选填“偏大”、“偏小”、“不变”,下同),
x的值会偏大.
(三)炼铁过程的探究
(1)写出工业上用赤铁矿(主要成分Fe2O3)炼铁主要原理的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
【查阅资料】用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO$\frac{\underline{\;500~600℃\;}}{\;}$2Fe3O4+CO2
阶段2:Fe3O4+CO$\frac{\underline{\;600~700℃\;}}{\;}$3FeO+CO2
阶段3:FeO+CO $\frac{\underline{\;>700℃\;}}{\;}$ Fe+CO2
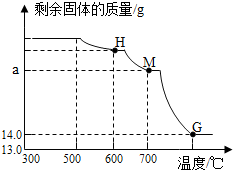
(2).将上述300℃热分解后的D装置中剩余固体继续分阶段升温,进行CO还原铁的氧化物炼铁过程的探究.加热时测定D中剩余固体质量随温度变化的曲线如图所示.图中M点对应的a=18.
分析 (一)铁能和胃液中的稀盐酸反应生成氯化亚铁和氢气;
(二)铁和水、氧气同时接触时容易生锈,氯化钠溶液能够促进铁生锈;
铁和水、氧气反应生成氢氧化亚铁;
凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
氢氧化钠溶液能够吸收二氧化碳,并且能和二氧化碳反应生成碳酸钠和水;
根据装置中的质量变化情况可以进行相关方面的计算;
碱石灰能够吸收水蒸气和二氧化碳;
(三)高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳;
图中M点对应的a点是反应生成氧化亚铁的质量.
解答 解:(一)铁和稀盐酸反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
故填:Fe+2HCl═FeCl2+H2↑.
(二)(1)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是C,这是因为氯化钠溶液能够促进铁生锈.
故填:C.
(2)Fe→Fe(OH)2反应的化学方程式为:2Fe+O2+2H2O=2Fe(OH)2.
故填:2Fe+O2+2H2O=2Fe(OH)2.
(3)①装配好实验装置后,首先要检查装置气密性.
故填:检查装置气密性.
②通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放氢氧化钠溶液,用来吸收二氧化碳气体.
故填:c.
③设碳酸亚铁质量为m,
装置F增重2.2g,说明碳酸亚铁分解生成了2.2g二氧化碳,装置E增重3.6g,说明铁锈中的结晶水的质量是3.6g,
FeCO3$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO2↑,
116 44
m 2.2g
$\frac{116}{x}$=$\frac{44}{2.2g}$,
x=5.8g,
铁锈中氧化铁质量为:25.4g-5.8g-3.6g=16g,
根据题意有:16g:3.6g=160:18x,
x=2.
故填:5.8;2.
④若缺少G装置,空气中的水蒸气和二氧化碳会进入F中,导致二氧化碳质量偏大,从而导致测得的碳酸亚铁质量偏大;
碳酸亚铁质量偏大时,会导致计算的氧化铁质量偏小,从而导致测定的x值偏大.
故填:偏大;偏大.
(三)(1)写出工业上用赤铁矿(主要成分Fe2O3)炼铁主要原理的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)图中M点对应的a点是反应生成氧化亚铁的质量,铁锈中铁元素质量为:5.8g×$\frac{56}{116}$×100%+16g×$\frac{112}{160}$×100%=14g,则生成氧化亚铜质量为:
14g÷($\frac{56}{72}$×100%)=18g,
图中M点对应的a=18.
故填:18.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 阅读快车系列答案
阅读快车系列答案| 选项 | 物质 | 加入的试剂和操作 |
| A | O2(CO2) | 通过灼热的铜网 |
| B | CaCO3(CaO) | 高温煅烧 |
| C | Cu(NO3)2溶液(AgNO3) | 足量铜粉,过滤 |
| D | CO2(CO) | 空气,点燃 |
| A. | A | B. | B | C. | C | D. | D |
(1)填写下列物质(或主要成分)的化学式或其用途(只需写一条).
物质 |  |  |  |  |
| 化学式 | NaCl | C | ③NaHCO3 | CaO④CaO |
| 用途 | ①做调味品、生理盐水、选种、化工原料、消除积雪等 | ②切割大理石、做装饰品(钻石)等 | 做发酵粉 | 做干燥剂 |

(3)尿素是一种常用的化肥,工业上生产尿素的反应的微观示意图如下:
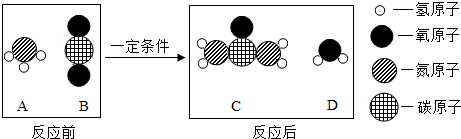
①尿素属于氮(填“氮”、“磷”或“钾”)肥.
②生产尿素的反应中,A与 B的质量比为17:22.
(4)治理和预防PM2.5污染物意义重大.
图是东台本地PM2.5来源分布图.据此,下列措施对减少PM2.5效果比较明显的是ABC.
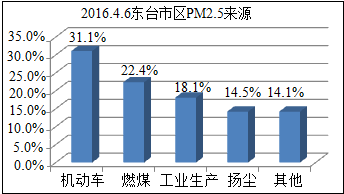
A.植树造林
B.减少汽车的保有量
C.用风能与太阳能发电替代燃煤发电.
 二氧化锰和硫酸铜溶液都可作为过氧化氢分解的催化剂.在一节化学实验课上,小花同学向10g过氧化氢中加入1.65g溶质质量分数为10%的硫酸铜溶液.实验过程中溶液总质量与反应时间的关系如图所示.求:
二氧化锰和硫酸铜溶液都可作为过氧化氢分解的催化剂.在一节化学实验课上,小花同学向10g过氧化氢中加入1.65g溶质质量分数为10%的硫酸铜溶液.实验过程中溶液总质量与反应时间的关系如图所示.求: