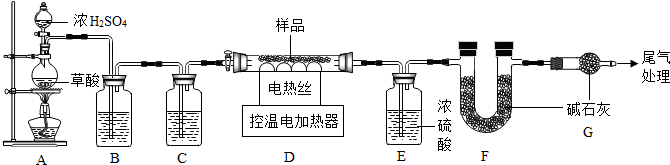
题目内容
13.化学与生活密切相关,化学使我们的生活更加美好:(1)填写下列物质(或主要成分)的化学式或其用途(只需写一条).
物质 |  |  |  |  |
| 化学式 | NaCl | C | ③NaHCO3 | CaO④CaO |
| 用途 | ①做调味品、生理盐水、选种、化工原料、消除积雪等 | ②切割大理石、做装饰品(钻石)等 | 做发酵粉 | 做干燥剂 |

(3)尿素是一种常用的化肥,工业上生产尿素的反应的微观示意图如下:
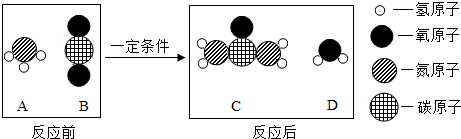
①尿素属于氮(填“氮”、“磷”或“钾”)肥.
②生产尿素的反应中,A与 B的质量比为17:22.
(4)治理和预防PM2.5污染物意义重大.
图是东台本地PM2.5来源分布图.据此,下列措施对减少PM2.5效果比较明显的是ABC.
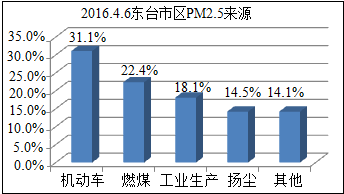
A.植树造林
B.减少汽车的保有量
C.用风能与太阳能发电替代燃煤发电.
分析 (1)性质决定用途,用途体现了物质的性质.首先根据题意确定物质的化学名称,然后根据书写化学式的方法和步骤写出物质的化学式即可.
(2)根据物质所含的营养素进行分析.
(3)根据图示中相关的物质的结构判断其化学式并书写出相关的方程式进行解答.
(4)对PM2.5影响的是烟尘、粉尘等,减少汽车尾气的排放、植树造林、用风能与太阳能发电替代燃煤发电,都能有利减少烟尘、粉尘;工业生产中主要排放的是二氧化碳,减缓温室效应,与PM2.5没有什么直接关系.
解答 解:(1)氯化钠俗称食盐,是一种生活中重要的调味品,也可以配制生理盐水、选种、做化工原料以及融雪剂等;
金刚石是硬度最大的矿物之一,可以切割玻璃、制成钻探机的钻头等,也可以做装饰品;
小苏打是碳酸氢钠的俗称,其化学式为NaHCO3;
生石灰是氧化钙的俗称,其化学式为CaO.
(2)A、植物油富含油脂,所以错误.
B、牛肉片中所含的主要营养素是蛋白质,所以错误.
C、馒头中所含的主要营养素是淀粉,淀粉属于糖类,所以正确.
故选C.
(3)①由尿素[CO(NH2)2]可知,尿素由碳、氧、氮、氢元素组成,属于氮肥;
②图示中相关的物质的结构判断可知A为氨气(NH3)、B为二氧化碳(CO2)、C为尿素[CO(NH2)2]、D为水(H2O),其相关的方程式为2NH3+CO2$\frac{\underline{\;一定条件\;}}{\;}$CO(NH2)2+H2O,所以A与B的质量比为34:44=17:22.
(4)A、植树造林,有利于空气的净化,部分植物可以吸附阻挡粉尘,对减少PM2.5效果明显,故符合题意;
B、减少汽车的保有量,可以减少汽车尾气的排放,减少烟尘,对减少PM2.5效果明显,故符合题意;
C、用风能与太阳能发电替代燃煤发电,减少了烟雾粉尘的排放,对减少PM2.5效果明显,故符合题意;
故选:ABC.
故填:(1)①做调味品、生理盐水、选种、化工原料、消除积雪等;②切割大理石、做装饰品(钻石)等(合理均可);③NaHCO3 ④CaO;(2)C;(3)①氮;②17:22;(4)ABC.
点评 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写等是正确解答此类题的关键所在.

| 选项 | 归类 | 物质或微粒 |
| A | 三大合成材料 | 塑料、合成橡胶、合成纤维 |
| B | 三大化石燃料 | 煤、石油、天然气 |
| C | 构成物质的三大微粒 | 分子、原子、离子 |
| D | 同一物质的三个俗名 | 火碱、烧碱、纯碱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 谷氨酸钠相对分子质量为169 | |
| B. | 谷氨酸钠是由5个碳原子、8个氢原子、4个氧原子、1个氮原子和1个钠原子构成 | |
| C. | 20℃时,100g水最多可配制成171.7g谷氨酸钠的饱和溶液 | |
| D. | 谷氨酸钠中钠元素的质量分数约为13.6% |
| A. | 铁、硫、石蜡在氧气中的燃烧都是化合反应 | |
| B. | 木炭在氧气中燃烧发出白光,生成无色无味的二氧化碳气体 | |
| C. | 硫在空气中燃烧发出明亮的蓝紫色火焰 | |
| D. | 物质与氧气的反应属于氧化反应,氧气具有氧化性 |
| A. | 搅拌后加热前一定是不饱和溶液 | B. | 搅拌后加热前一定是饱和溶液 | ||
| C. | 加热后一定是饱和溶液 | D. | 加热后一定是不饱和溶液 |