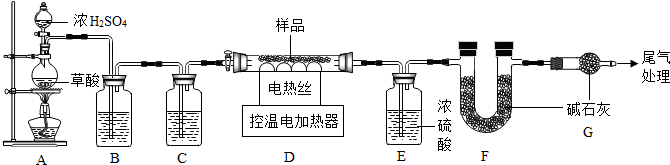
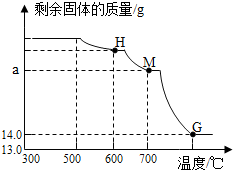
题目内容
14. 二氧化锰和硫酸铜溶液都可作为过氧化氢分解的催化剂.在一节化学实验课上,小花同学向10g过氧化氢中加入1.65g溶质质量分数为10%的硫酸铜溶液.实验过程中溶液总质量与反应时间的关系如图所示.求:
二氧化锰和硫酸铜溶液都可作为过氧化氢分解的催化剂.在一节化学实验课上,小花同学向10g过氧化氢中加入1.65g溶质质量分数为10%的硫酸铜溶液.实验过程中溶液总质量与反应时间的关系如图所示.求:(1)反应生成氧气的质量;
(2)过氧化氢溶液中溶质质量分数;
(3)反应结束后,硫酸铜溶液中溶质的质量为0.165g.
分析 (1)根据质量守恒定律,液体总质量的减少为生成氧气的质量;
(2)根据氧气的质量结合化学方程式,可以计算过氧化氢的质量,进一步计算过氧化氢溶液中溶质质量分数;
(3)根据催化剂的特点分析.
解答 解:(1)根据质量守恒定律,生成氧气的质量为:10g+1.65g-11.33g=0.32g
(2)设过氧化氢溶液中溶质的质量为x.
2H2O2$\frac{\underline{\;CuSO_{4}\;}}{\;}$2H2O+O2↑
68 32
x 0.32g
$\frac{68}{x}=\frac{32}{0.32g}$
x=0.68g
过氧化氢溶液中溶质质量分数为$\frac{0.68g}{10g}×100%$=6.8%
(3)硫酸铜作为催化剂,反应前后硫酸铜的质量不变.
反应结束后,硫酸铜溶液中溶质的质量为1.65g×10%=0.165g
答:反应结束后,硫酸铜溶液中溶质的质量为0.165g.
点评 本题难度不是很大,理解图形分析反应的进程、抓住“三点一趋势”(起点、拐点、终点和图象的变化趋势)、分析图象中所给数据的含义、正确的运用有关数据解决问题是解答此类题目的关键所在.

练习册系列答案
相关题目
5. A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是( )
A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是( )
 A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是( )
A、B、C、D分别为氧化铁、盐酸、氢氧化钙、碳酸钙中的一种,它们之间的反应或转化关系如图(部分物质和反应条件已略去).其中说法不正确的是( )| A. | C物质是盐酸 | |
| B. | 反应①的化学方程式可以是:CO2+Ca(OH)2═CaCO3↓+H2O | |
| C. | 反应②中所得溶液呈浅绿色 | |
| D. | 反应③中D物质可发生还原反应得到铁 |
2.小亮同学设计如图装置来制取并收集气体,你认为他能制得的气体是( )
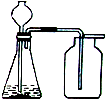

| A. | 用KMnO4粉末制取O2 | |
| B. | 用KClO3和MnO2制取O2 | |
| C. | 用Zn(固体)和稀硫酸制(液体)取H2 (密度比空气小,难溶于水) | |
| D. | 用石灰石(固体)和稀盐酸(液体)制取CO2(密度比空气大,溶于水) |
4.下列归类错误的是
( )
| 选项 | 归类 | 物质或微粒 |
| A | 三大合成材料 | 塑料、合成橡胶、合成纤维 |
| B | 三大化石燃料 | 煤、石油、天然气 |
| C | 构成物质的三大微粒 | 分子、原子、离子 |
| D | 同一物质的三个俗名 | 火碱、烧碱、纯碱 |
| A. | A | B. | B | C. | C | D. | D |
 根据某学生在实验室用加热高锰酸钾制取氧气的操作步骤,进行填空并回答有关问题.
根据某学生在实验室用加热高锰酸钾制取氧气的操作步骤,进行填空并回答有关问题.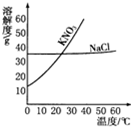 根据如图中KNO3和NaCl的溶解度曲线,回答下列问题.
根据如图中KNO3和NaCl的溶解度曲线,回答下列问题.