题目内容
2.水垢的主要成分是CaCO3和Mg(OH)2,小红同学从定性、定量两个角度对此进行了探究(其他成分忽略不计).【查阅资料】Mg(OH)2受热分解生成两种氧化物.
【进行实验】小红用下图所示装置进行实验,定性探究水垢的成分.
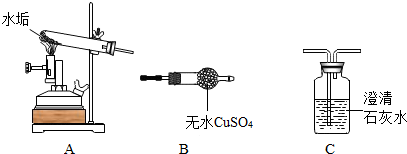
(1)小红同学将装置按A、B、C(填“B”“C”)的顺序组合进行实验,得出水垢中既含有CaCO3又还有Mg(OH)2.
(2)实验时,B中的现象为色粉末变成蓝色,C中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
【拓展延伸】进一步探究水垢中的两种物质的质量之比.
已知Mg(OH)2的分解温度为340℃~490℃,CaCO3的分解温度为825℃~897℃.下图为用热分析仪对固体分解所得固体质量与分解温度关系图,请据图回答问题:
(3)写出AB、CD段发生反应的化学方程式:

AB段:Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;
CD段:CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑.
(4)通过计算得到CaCO3与Mg(OH)2的质量之比(最简单整数比)为100:29.
分析 (1)根据无水硫酸铜遇水变蓝进行分析,根据检验水要放在检验二氧化碳的前面进行分析;
(2)根据硫酸铜遇水变蓝,根据氢氧化钙会与二氧化碳反应生成碳酸钙沉淀进行分析;
(3)根据氢氧化镁和碳酸钙的分解温度进行分析,
(4)根据氢氧化铜和碳酸铜分解的化学方程式进行分析.
解答 解:
(1)要证明生成物中有水和二氧化碳,应先证明水再证明二氧化碳,若先证明二氧化碳的话,即使原气体中没有水蒸汽,气体通过石灰水后也会从石灰水中带出水蒸汽.故答案为B、C;
(2)实验时,B中的现象为白色粉末变成蓝色;二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O
(3)AB段的温度大于340℃但是没有超过825℃,从图象中看出符合氢氧化镁的分解温度,CD段的温度超过了825℃,符合碳酸钙的分解温度,
故AB段是Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,CD段是CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑,
(4)设氢氧化镁的质量为x,碳酸钙的质量为y
Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑
58 18 100 44
x 0.9g y 4.4g
$\frac{58}{x}=\frac{18}{0.9}$ $\frac{100}{y}=\frac{44}{4.4g}$
x=2.9g y=10g
CaCO3与Mg(OH)2的质量之比(最简单整数比)为:10g:2.9g=100:29
答案:
(1)B、C;
(2)白色粉末变成蓝色;CO2+Ca(OH)2═CaCO3↓+H2O;
(3)Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O;CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑;
(4)100:29
点评 在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答,此类题难度较大,要细心进行分析解答.

| A. | Ti可以表示一个钛原子 | B. | Ti4+核外有26个电子 | ||
| C. | TiO2中含有氧分子 | D. | CaTiO3属于金属氧化物 |
| A. | Cl | B. | Cl2 | C. | Al | D. | AL |
| A. | 洗脸、涮牙时不间断地放水 | B. | 洗澡擦肥皂时不关喷头,任水流 | ||
| C. | 任由水龙头漏水而不及时修理 | D. | 洗菜、淘米的水用来浇花 |
