题目内容
10.向50.0g溶质的质量分数为 8.0%的氢氧化钠溶液中加入50.0g的稀硫酸恰好完全反应,此时溶液pH=7.请计算:(1)求反应前氢氧化钠溶液中溶质的质量.
(2)求反应后所得溶液中溶质的质量分数.
分析 根据溶质质量分数公式以及化学方程式进行计算,氢氧化钠能与硫酸反应生成硫酸钠和水,据此分析解答即可.
解答 解:(1)所用氢氧化钠溶液中溶质的质量为50.0g×8.0%=4.0g;
(2)设生成硫酸钠的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 142
4.0g x
$\frac{80}{4.0g}=\frac{142}{x}$
解得:x=7.1g
反应后生成硫酸钠溶液的质量分数为:$\frac{7.1g}{50.0g+50.0g}$×100%=7.1%.
答:反应后生成硫酸钠溶液的质量分数为7.1%.
点评 此题是根据化学方程式计算的题目,解题的关键是根据已知量根据化学方程式对未知量进行的求解,属基础性计算考查题.

练习册系列答案
相关题目
20.如图是工业生产水煤气的化学反应微观示意图,有关叙述错误的是( )


| A. | 该反应是置换反应 | B. | 图中气体单质的化学式为H2 | ||
| C. | 反应后原子的个数减少 | D. | 水煤气泄漏会污染空气 |
1.下列有关物质混合后的现象描述中,正确的是( )
| A. | 在无色碘化钾溶液中滴加淀粉溶液,溶液变蓝 | |
| B. | 无色的氯化氢气体和氨气混合,产生白雾 | |
| C. | 在氢氧化钠稀溶液中滴加数滴硫酸铜溶液,产生蓝色絮状沉淀 | |
| D. | 无色碘化钾溶液中加入硝酸银溶液,产生白色沉淀 |
18.下列有关描述中,不正确的是( )
| A. | 清理沼气池前做灯火实验 | B. | 进入山洞时用火把照明 | ||
| C. | 煮沸能降低水的硬度 | D. | 天然气泄漏,立即关闭阀门 |
5.下列图象能反映所对应叙述关系的是( )
| A. | 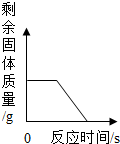 表示一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系 | |
| B. | 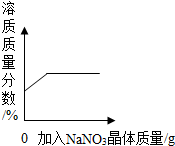 表示t℃时向饱和硝酸钠溶液中加入硝酸钠晶体,溶质质量分数与加入量的关系 | |
| C. | 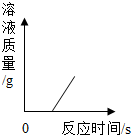 表示一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系 | |
| D. | 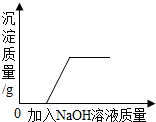 表示向盐酸和氯化铜混合溶液中加入氢氧化钠,沉淀质量与加入量的关系 |
19.将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(Na)$\stackrel{O_{2}}{→}$钠的氧化物$\stackrel{H_{2}O}{→}$氢氧化钠溶液$\stackrel{CO_{2}}{→}$白色固体
[提出问题]
常温下钠与氧气反应,产物有哪些?
[查阅资料]
钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠和过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
[作出猜想]
常温下钠与氧气反应的产物.
猜想1:Na2O;
猜想2:Na2O2;
猜想3:Na2O和Na2O2.
[实验探究一]
[继续探究]钠在空气中放置一段时间后得到的白色固体的成分.
[作出猜想]
猜想一:Na2CO3,
猜想二,Na2CO3和NaOH
[实验探究二]
[实验反思]
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式Na2O+2HCl=2NaCl+H2O.
(2)过氧化钠也能与盐酸反应,方程式为2Na2O2+4HCl═4NaCl+2H2O+X↑,X的化学式为O2.
钠(Na)$\stackrel{O_{2}}{→}$钠的氧化物$\stackrel{H_{2}O}{→}$氢氧化钠溶液$\stackrel{CO_{2}}{→}$白色固体
[提出问题]
常温下钠与氧气反应,产物有哪些?
[查阅资料]
钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠和过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
[作出猜想]
常温下钠与氧气反应的产物.
猜想1:Na2O;
猜想2:Na2O2;
猜想3:Na2O和Na2O2.
[实验探究一]
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | 没有气泡生成 | 猜想1正确 |
[作出猜想]
猜想一:Na2CO3,
猜想二,Na2CO3和NaOH
[实验探究二]
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量氯化钙溶液 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.过滤,取少量滤液加入无色的酚酞试液 | 变成红色 |
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式Na2O+2HCl=2NaCl+H2O.
(2)过氧化钠也能与盐酸反应,方程式为2Na2O2+4HCl═4NaCl+2H2O+X↑,X的化学式为O2.
20.实验室有三瓶密封完好的相同气体,小华同学通过下列实验确定该气体的成分.请根据下表中的实验步骤和现象,并在O2、N2、CO、CO2、CH4、SO2中推断可能的结果及结论填入表中空白处.
| 实验步骤 | 实验现象 | 推断结果及结论 |
| (1)取一瓶气体,小心闻 其气味 | 无气味 | 瓶中的气体一定不是SO2; |
| (2)慢慢移开另一瓶的玻璃片,同时将一燃着的木条缓慢伸入瓶中 | 瓶口处未见明显现象 伸入瓶中,木条上的火焰熄灭 | 一定不是CO、CH4; 一定不是O2; |
| (3)向第三个瓶中注入少量澄清石灰水,振荡 | 石灰水变浑浊 | 你的结论:瓶中气体一定含有CO2,可能含有N2. |
 我国原油对外进口的依存度2013年是57%,而且以每年增长率为4%的速度递增,解决能源问题非常紧迫.太阳能的利用极大地解决了化石资源面临耗尽的问题,请回答有关问题:
我国原油对外进口的依存度2013年是57%,而且以每年增长率为4%的速度递增,解决能源问题非常紧迫.太阳能的利用极大地解决了化石资源面临耗尽的问题,请回答有关问题:
