题目内容
11.可用于金属除锈的是稀盐酸或稀硫酸等.分析 根据金属表面的锈的主要成分是金属的氧化物,能与酸反应,进行分析解答.
解答 解:金属表面的锈的主要成分是金属的氧化物,能与酸反应,可用于金属除锈的是稀盐酸或稀硫酸等.
故答案为:稀盐酸或稀硫酸等.
点评 本题难度不大,物质的性质决定物质的用途,掌握常见酸的性质和用途是正确解答此类题的关键.

练习册系列答案
相关题目
1.下列有关物质混合后的现象描述中,正确的是( )
| A. | 在无色碘化钾溶液中滴加淀粉溶液,溶液变蓝 | |
| B. | 无色的氯化氢气体和氨气混合,产生白雾 | |
| C. | 在氢氧化钠稀溶液中滴加数滴硫酸铜溶液,产生蓝色絮状沉淀 | |
| D. | 无色碘化钾溶液中加入硝酸银溶液,产生白色沉淀 |
19.将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(Na)$\stackrel{O_{2}}{→}$钠的氧化物$\stackrel{H_{2}O}{→}$氢氧化钠溶液$\stackrel{CO_{2}}{→}$白色固体
[提出问题]
常温下钠与氧气反应,产物有哪些?
[查阅资料]
钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠和过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
[作出猜想]
常温下钠与氧气反应的产物.
猜想1:Na2O;
猜想2:Na2O2;
猜想3:Na2O和Na2O2.
[实验探究一]
[继续探究]钠在空气中放置一段时间后得到的白色固体的成分.
[作出猜想]
猜想一:Na2CO3,
猜想二,Na2CO3和NaOH
[实验探究二]
[实验反思]
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式Na2O+2HCl=2NaCl+H2O.
(2)过氧化钠也能与盐酸反应,方程式为2Na2O2+4HCl═4NaCl+2H2O+X↑,X的化学式为O2.
钠(Na)$\stackrel{O_{2}}{→}$钠的氧化物$\stackrel{H_{2}O}{→}$氢氧化钠溶液$\stackrel{CO_{2}}{→}$白色固体
[提出问题]
常温下钠与氧气反应,产物有哪些?
[查阅资料]
钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠和过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
[作出猜想]
常温下钠与氧气反应的产物.
猜想1:Na2O;
猜想2:Na2O2;
猜想3:Na2O和Na2O2.
[实验探究一]
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | 没有气泡生成 | 猜想1正确 |
[作出猜想]
猜想一:Na2CO3,
猜想二,Na2CO3和NaOH
[实验探究二]
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量氯化钙溶液 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.过滤,取少量滤液加入无色的酚酞试液 | 变成红色 |
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式Na2O+2HCl=2NaCl+H2O.
(2)过氧化钠也能与盐酸反应,方程式为2Na2O2+4HCl═4NaCl+2H2O+X↑,X的化学式为O2.
6.水是生产生活中不可缺少的物质.下列关于水的说法中正确的是( )
| A. | 明矾溶液可以区分硬水和软水 | |
| B. | 在自来水厂净化水的过程中,发生的变化都是物理变化 | |
| C. | 洗米后的水,可以用于浇花 | |
| D. | 为了节约用水,可以用工业废水直接浇灌农田 |
3. 中国有着悠久的饮酒酿酒文化.不久前,海昏侯墓葬出土了青铜“蒸馏器”(图1),“蒸馏器”上遍体的铜锈[Cu2(OH)2CO3]见证了我国蒸馏酒的历史,使现代人对蒸馏酒的认识提早了1000年!
中国有着悠久的饮酒酿酒文化.不久前,海昏侯墓葬出土了青铜“蒸馏器”(图1),“蒸馏器”上遍体的铜锈[Cu2(OH)2CO3]见证了我国蒸馏酒的历史,使现代人对蒸馏酒的认识提早了1000年!
白酒一般是用高粱等谷物做主料或佐料酿制而成.制酒工艺主要流程包括:投料→发酵→蒸馏→老熟(贮存).
发酵是指借助酵母菌所产生的酶的作用,使高粱等籽粒中的淀粉转化为葡萄糖(C6H12O6),葡萄糖在酶的作用下进一步氧化产生酒精和二氧化碳等.发酵环境pH为4-5时,发酵速度快,超出这个范围,就会抑制酵母繁殖,发酵速率减慢,且出酒率降低.在正常条件下,发酵池中酒精含量随时间的变化情况如图2所示:发酵得到的并不是通常市场上见到的饮用酒,其酒精含量一般在6-7%,同时含有多种脂类、醛和酸.一般需要蒸馏和浓缩,使酒精浓度达到50-70%,蒸馏得到的酒中还含有杂酯油及酯类等.新蒸出的白酒,气味不正,因为新酒中含有硫化氢、硫醇等臭味物质.硫化氢、硫醇等低沸点物质挥发出来后,酒的杂味会大为减少,所以需要贮
存老熟的过程.老熟过程中臭味物质的变化如下表所示.
老熟过程中会发生氧化、还原、酯化、水解等各种反应,使酒中醇、酸、酯、醛等物质达到最佳值,酒香气增加,酒味柔和.清香型酒的主体香是乙酸乙酯,在老熟1年半左右时间达到最高值,贮存期延长,主体香成分反而下降,老熟10年的酒,其主体香成分降低大约75%.说明白酒必须有一定的贮存期.
回答下列问题:
(1)铜锈由铜、碳、氢、氧四种元素组成.
(2)酵母菌繁殖的适宜环境属于酸性(填酸性、中性或碱性).
(3)在粮食发酵生成酒精过程中,酒精含量增长最快的时间C.
A.发酵前两天 B.发酵7天以后 C.在发酵中期
(4)酿酒过程中“老熟”的目的是除去酒中的有害物质.
(5)在饮酒、酒酿制过程要注意的问题,不正确的是ACD.
A.酒越陈越香
B.老熟过程只发生化学变化
C.发酵期越长,发酵池中酒精含量越高
D.白酒的香味是酒精的气味.
 中国有着悠久的饮酒酿酒文化.不久前,海昏侯墓葬出土了青铜“蒸馏器”(图1),“蒸馏器”上遍体的铜锈[Cu2(OH)2CO3]见证了我国蒸馏酒的历史,使现代人对蒸馏酒的认识提早了1000年!
中国有着悠久的饮酒酿酒文化.不久前,海昏侯墓葬出土了青铜“蒸馏器”(图1),“蒸馏器”上遍体的铜锈[Cu2(OH)2CO3]见证了我国蒸馏酒的历史,使现代人对蒸馏酒的认识提早了1000年!白酒一般是用高粱等谷物做主料或佐料酿制而成.制酒工艺主要流程包括:投料→发酵→蒸馏→老熟(贮存).
发酵是指借助酵母菌所产生的酶的作用,使高粱等籽粒中的淀粉转化为葡萄糖(C6H12O6),葡萄糖在酶的作用下进一步氧化产生酒精和二氧化碳等.发酵环境pH为4-5时,发酵速度快,超出这个范围,就会抑制酵母繁殖,发酵速率减慢,且出酒率降低.在正常条件下,发酵池中酒精含量随时间的变化情况如图2所示:发酵得到的并不是通常市场上见到的饮用酒,其酒精含量一般在6-7%,同时含有多种脂类、醛和酸.一般需要蒸馏和浓缩,使酒精浓度达到50-70%,蒸馏得到的酒中还含有杂酯油及酯类等.新蒸出的白酒,气味不正,因为新酒中含有硫化氢、硫醇等臭味物质.硫化氢、硫醇等低沸点物质挥发出来后,酒的杂味会大为减少,所以需要贮
存老熟的过程.老熟过程中臭味物质的变化如下表所示.
| 酒别(单位:g/100ml) | 硫化氢 | 硫醇 |
| 新酒 | 0.00888 | 痕迹 |
| 贮存一年的酒 | 痕迹 | 未检出 |
| 贮存二年的酒 | 痕迹 | 未检出 |
回答下列问题:
(1)铜锈由铜、碳、氢、氧四种元素组成.
(2)酵母菌繁殖的适宜环境属于酸性(填酸性、中性或碱性).
(3)在粮食发酵生成酒精过程中,酒精含量增长最快的时间C.
A.发酵前两天 B.发酵7天以后 C.在发酵中期
(4)酿酒过程中“老熟”的目的是除去酒中的有害物质.
(5)在饮酒、酒酿制过程要注意的问题,不正确的是ACD.
A.酒越陈越香
B.老熟过程只发生化学变化
C.发酵期越长,发酵池中酒精含量越高
D.白酒的香味是酒精的气味.
20.实验室有三瓶密封完好的相同气体,小华同学通过下列实验确定该气体的成分.请根据下表中的实验步骤和现象,并在O2、N2、CO、CO2、CH4、SO2中推断可能的结果及结论填入表中空白处.
| 实验步骤 | 实验现象 | 推断结果及结论 |
| (1)取一瓶气体,小心闻 其气味 | 无气味 | 瓶中的气体一定不是SO2; |
| (2)慢慢移开另一瓶的玻璃片,同时将一燃着的木条缓慢伸入瓶中 | 瓶口处未见明显现象 伸入瓶中,木条上的火焰熄灭 | 一定不是CO、CH4; 一定不是O2; |
| (3)向第三个瓶中注入少量澄清石灰水,振荡 | 石灰水变浑浊 | 你的结论:瓶中气体一定含有CO2,可能含有N2. |
1.常用抗生素“先锋Ⅵ”为粉末状固体,每瓶含“先锋Ⅵ”0.5g,注射时应配成质量分数不高于20%的溶液,则使用时每瓶至少需加入蒸馏水( )
| A. | 4mL | B. | 3mL | C. | 2mL | D. | 1mL |
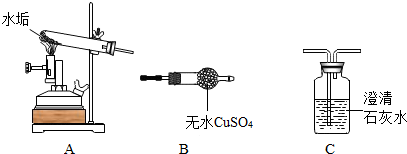

 某同学组织化学兴趣小组的学生到郊外野炊.
某同学组织化学兴趣小组的学生到郊外野炊. 表示氧原子,
表示氧原子, 表示碳原子).
表示碳原子).