题目内容
6.某兴趣小组对“铁锈(Fe2O3)与盐酸反应快慢的影响因素”进行了探究.【提出问题】铁锈与盐酸反应的快慢受哪些因速的影响呢?
【猜想与假设】a.可能与盐酸的质量分数有关;
b.可能与反应的温度有关.
【设计实验】用相同质量的铁锈和足量的盐酸进行如表实验.
| 实验编号 | 盐酸的质量分数 | 反应的速度 | 铁锈消失的时间 |
| ① | 6% | 20℃ | 240 s |
| ② | 10% | 20℃ | 115 s |
| ③ | 10% | 30℃ | 75 s |
(2)要比较温度对反应快慢的影响,应选择的实验编号是②③.
【得出结论】(3)从以上实验中可得出的结论是①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快.
【实验拓展】(4)随后在铁锈与盐酸反应的试管中加入少量硫酸,发现反应明显加快,可能是硫酸中H+(填化学符号)加快了反应的速率,请设计一个合理的实验来验证你的假设在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用.
(5)铁锈与盐酸反应的快慢可能还受哪些因速影响?设计实验验证.
分析 (1)根据铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水解答;
(2)根据控制变量法进行分析;
(3)根据表格信息来分析;
(4)根据硫酸酸中存在的离子来分析;可根据加入含有硫酸根离子的化合物的溶液观察反应速率快慢来分析;
(5)反应速率的快慢还可能与铁锈和酸的接触面积有关.
解答 解:
(1)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.
(2)由表格信息可知,要比较温度对反应快慢的影响,应选择的实验编号是②③;酸的溶质质量分数相同,温度越高,反应时间越短,反应速率越快;
(3)实验①②中盐酸的质量分数不同,温度相同,酸的溶质质量分数越大,反应速率越快;
实验②③中酸的溶质质量分数相同,温度越高,反应时间越短,反应速率越快;
从以上实验中可得出的结论是①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快;
(4)硫酸酸中存在氢离子和硫酸根离子,其中加快反应速率的离子是氢离子,故填:H+;
在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用,
(4)铁锈与酸的接触面积也可能会影响反应的速率,故填:将长短相同、粗细不同的两根生锈的铁丝放入等体积、等溶质质量分数的稀盐酸中,观察现象.发现细铁丝表面的铁锈很快就被除去,而粗铁丝表面的铁锈较慢,故可推断出铁锈和酸反应的快慢还与铁锈与酸的接触面积有关.
答案:
(1)Fe2O3+6HCl═2FeCl3+3H2O;
(2)②③;
(3)①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快;
(4)H+;在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用;
(5)将长短相同、粗细不同的两根生锈的铁丝放入等体积、等溶质质量分数的稀盐酸中,观察现象.发现细铁丝表面的铁锈很快就被除去,而粗铁丝表面的铁锈较慢,故可推断出铁锈和酸反应的快慢还与铁锈与酸的接触面积有关.
点评 本题是通过控制不同的量来探究能够影响反应速度的因素的,这类似于物理上所学的控制变量法来解决问题,我们在解答时要注意仔细分析比较,从而得出正确的解答.

(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属铁的位置移到最后,正好符合由弱到强的金属活动性顺序.
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属.如图1所示用品中,利用金属导热性的是A,延展性的是BC(填字母序号).
(3)某小组用图2所示装置对铁生锈的条件进行探究.4min后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是此题综合考查学生对金属有关知识的掌握程度,提高分析和解决实际问题的能力,是中考考试的热点..
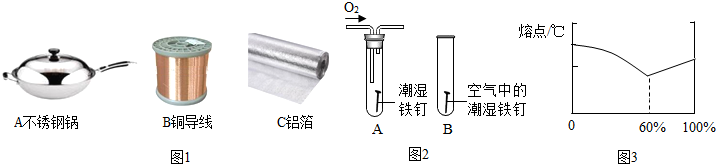
(4)铜也容易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和二氧化碳共同作用的结果.
(5)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.一般来说,合金的熔点低于任何一种组成金属的熔点.如表是一些金属的熔点数据.
| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
②保险丝由铋、铅、锡、镉组成,其熔点约为B.
A.15~30℃; B.60~80℃;
C.235~250℃; D.300~320℃.
| A. | 三氯化磷中磷元素的化合价为+3 | |
| B. | 运输过程中如果发生燃烧时,可以用水浇灭 | |
| C. | 运输途中应防雨淋和防高温 | |
| D. | 三氯化磷与水反应的化学方程式:PCl3+3H20═H3PO3+3HCl↑ |
| A. | 苹果、草莓 | B. | 米饭、面条 | C. | 牛肉、豆奶 | D. | 花生、菜籽油 |
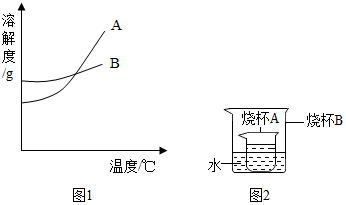 根据下面的溶解度表与溶解度曲线(图1),回答下列问题:
根据下面的溶解度表与溶解度曲线(图1),回答下列问题:| 温度/°C 溶解度/g | 0 | 20 | 40 | 60 | 80 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
(2)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是降温结晶.
(3)如图2所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,原因是氧化钙溶于水放热,导致氢氧化钙的溶解度变小.

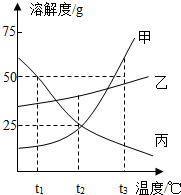 如图是甲、乙、丙三种物质的溶解度曲线.
如图是甲、乙、丙三种物质的溶解度曲线.