题目内容
13.某探究性学习小组设计了测定纯碱样品(含NaCl杂质)中碳酸钠质量分数的实验方案;请回答下列问题:(1)碳酸根离子沉淀法.实验步骤:
①用托盘天平称取wg样品放入烧杯中加水溶解;
②加入足量BaCl2溶液充分反应.
③过滤、洗涤、干燥、称量沉淀的质量为mg;
④样品中碳酸钠的质量分数为$\frac{106m}{197w}×100%$.(写出计算过程)
(2)气体法.学习小组利用如图装置测定样品中碳酸钠的质量分数.

①实验装置乙中盛放的试剂为浓硫酸,装置丁的作用是防止空气中的二氧化碳和水蒸气进入丙中.
②学习小组通过测量丙装置实验前后的质量.确定二氧化碳的质量.实验中滴加稀硫酸的速度过快,产生的气流过急.会导致测得样品中碳酸钠的质量分数偏低(填写“偏高”“偏低”或“不变”).
分析 (1)④根据白色沉淀碳酸钡的质量可以求出碳酸钠的质量,进一步可以求出样品中碳酸钠的质量分数;
(2)装置分析可知,含NaCl杂质中碳酸钠质量分数的测定,利用稀硫酸和样品反应生成二氧化碳,通过装置乙干燥二氧化碳,通过丙装置吸收二氧化碳,称重得到生成二氧化碳的质量,计算样品中碳酸钠质量分数,丁装置是防止空气中的二氧化碳进入装置丙,引起测定误差.
①浓硫酸具有吸水性,碱石灰能够吸收水和二氧化碳;
②如果气流过急,则二氧化碳不容易完全吸收.
解答 解:(1)④设碳酸钠的质量为x
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197
x mg
$\frac{106}{197}=\frac{x}{mg}$
x=$\frac{106m}{197}$g
样品中碳酸钠的质量分数为$\frac{106m}{197w}×100%$
故答案为:$\frac{106m}{197w}×100%$;
(2)①二氧化碳进入氢氧化钠溶液前应该除去水,浓硫酸具有吸水性,可以用浓硫酸除去二氧化碳中的水,为了防止空气中的二氧化碳和水蒸气影响实验结果,可以用碱石灰进行吸收.故答案为:浓硫酸,防止空气中的二氧化碳和水蒸气进入丙中.
②实验中滴加稀硫酸的速度过快,产生的气流过急,二氧化碳不能完全被氢氧化钠溶液吸收,导致测得样品中碳酸钠的质量分数偏低.故答案:偏低.
点评 本题考查了根据化学方程式进行计算时,要注意规范性,计算要准确,化学方程式要注意遵循质量守恒定律,即配平,题目难度中等.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
3.能正确表示将一定量的稀盐酸加入到足量的铁粉中的图象是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列有关物质的性质和用途描述不正确的是( )
| A. | 钨的熔点高,可以用来制作保险丝 | |
| B. | 不锈钢抗锈性能好,可用于作外科手术刀 | |
| C. | 石灰石在高温作用下分解,可用于制备生石灰 | |
| D. | 一氧化碳气体具有可燃性,可用于作气体燃料 |
1.下列4个坐标图分别表示4个实验过程中某些物质质量的变化,其中正确的是( )
| A. |  在某一密闭容器内点燃红磷 | |
| B. |  加热一定量氯酸钾和二氧化锰的固体混合物 | |
| C. |  向一定量石灰石中滴加稀盐酸 | |
| D. | 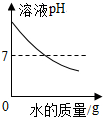 向氢氧化钠溶液中不断加水,溶液pH与加入水的质量关系 |
8.类推法是一种常见重要的学习方法,下列类推中错误的是( )
| A. | 铁、铜等很多金属难溶于水,铅是一种金属,铅可能也难溶于水 | |
| B. | 原子和分子均是微观粒子,在化学变化中原子不能再分,则分子也不能再分 | |
| C. | SO2与CO2一样,溶于水生成酸性物质,则SO2也能与NaOH溶液反应 | |
| D. | H2、CO、CH4气体燃烧前要进行验纯,其它可燃性气体不纯时也可能发生爆炸 |
5.携手“六城”同创,共建山青水绿、天蓝地净的美丽恩施.从化学的视角你认为下列不符合该主题的是( )
| A. | 绿化、亮化、美化环境 | B. | 必要时对私家车限行 | ||
| C. | 开发和利用新能源 | D. | 生活污水直排江河 |
6.某兴趣小组对“铁锈(Fe2O3)与盐酸反应快慢的影响因素”进行了探究.
【提出问题】铁锈与盐酸反应的快慢受哪些因速的影响呢?
【猜想与假设】a.可能与盐酸的质量分数有关;
b.可能与反应的温度有关.
【设计实验】用相同质量的铁锈和足量的盐酸进行如表实验.
(1)写出铁锈与盐酸反应的化学方程式Fe2O3+6HCl═2FeCl3+3H2O.
(2)要比较温度对反应快慢的影响,应选择的实验编号是②③.
【得出结论】(3)从以上实验中可得出的结论是①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快.
【实验拓展】(4)随后在铁锈与盐酸反应的试管中加入少量硫酸,发现反应明显加快,可能是硫酸中H+(填化学符号)加快了反应的速率,请设计一个合理的实验来验证你的假设在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用.
(5)铁锈与盐酸反应的快慢可能还受哪些因速影响?设计实验验证.
【提出问题】铁锈与盐酸反应的快慢受哪些因速的影响呢?
【猜想与假设】a.可能与盐酸的质量分数有关;
b.可能与反应的温度有关.
【设计实验】用相同质量的铁锈和足量的盐酸进行如表实验.
| 实验编号 | 盐酸的质量分数 | 反应的速度 | 铁锈消失的时间 |
| ① | 6% | 20℃ | 240 s |
| ② | 10% | 20℃ | 115 s |
| ③ | 10% | 30℃ | 75 s |
(2)要比较温度对反应快慢的影响,应选择的实验编号是②③.
【得出结论】(3)从以上实验中可得出的结论是①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快.
【实验拓展】(4)随后在铁锈与盐酸反应的试管中加入少量硫酸,发现反应明显加快,可能是硫酸中H+(填化学符号)加快了反应的速率,请设计一个合理的实验来验证你的假设在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用.
(5)铁锈与盐酸反应的快慢可能还受哪些因速影响?设计实验验证.
7.三氧化二锑(Sb2O3)能与过氧化氢发生如下反应:Sb2O3+2H2O2═X+2H2O,则X的化学式为( )
| A. | Sb2O | B. | SbO3 | C. | Sb2O3 | D. | Sb2O5 |