题目内容
12.人类的生产生活离不开金属材料.(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属铁的位置移到最后,正好符合由弱到强的金属活动性顺序.
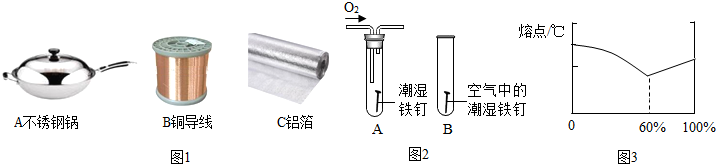
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属.如图1所示用品中,利用金属导热性的是A,延展性的是BC(填字母序号).
(3)某小组用图2所示装置对铁生锈的条件进行探究.4min后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是此题综合考查学生对金属有关知识的掌握程度,提高分析和解决实际问题的能力,是中考考试的热点..
(4)铜也容易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和二氧化碳共同作用的结果.
(5)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.一般来说,合金的熔点低于任何一种组成金属的熔点.如表是一些金属的熔点数据.
| 金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
| 熔点/℃ | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
②保险丝由铋、铅、锡、镉组成,其熔点约为B.
A.15~30℃; B.60~80℃;
C.235~250℃; D.300~320℃.
分析 (1)根据金属活动性顺序进行分析回答;
(2)物质的性质决定物质的用途,根据金属的性质和用途分析回答;
(3)铁生锈的条件是铁与氧气、水共同作用的结果,对比A、B两图,就是空气与氧气的差别;
(4)根据质量守恒定律、空气的成分及铜锈的主要成分碱式碳酸铜的组成元素分析;
(5)①根据横坐标质量分数为零时熔点要比质量分数为100%时熔点高考虑本题;根据合金熔点最低时铅和锡的含量考虑;②根据合金的熔点与其组成成分的熔点比较考虑;
解答 解:(1)由金属活动性顺序表可知,在“五金”顺序中把金属铁的位置移到最后,正好符合由弱到强的 金属活动性顺序;
(2)钢得出主要成分是铁,利用铁的传热性可以制成锅.利用金属的延展性,可以将铜拉成铜丝作导线.将铝制成铝箔;
(3)铁生绣的条件是铁与氧气、水共同作用的结果,对比A、B两图,就是空气与氧气的差别,故答案为:氧气的浓度;
(4)由于碱式碳酸铜中含有铜、氢、氧、碳四种元素组成,是铜与空气中的氧气、水和二氧化碳共同作用的结果.
(5)①横坐标质量分数为零时熔点要比质量分数为100%时熔点高,因为铅的熔点比锡的熔点高,所以横坐标表示锡的质量分数;合金熔点最低时锡占60%,所以铅占40%,合金中铅与锡的质量比为40%:60%=2:3;
②合金的熔点比它的组成成分熔点要低,铋、铅、锡、镉这四种物质熔点最低的是231.9,所以要选择熔点比231.9低,且不能很低,必须要高于室温,所以选择B.
故答案为:(1)铁;(2)A;BC;(3)氧气的浓度;(4)二氧化碳;(5)①锡;2:3; ②B.
点评 此题综合考查学生对金属有关知识的掌握程度,提高分析和解决实际问题的能力,是中考考试的热点.解答本题关键是要知道合金的熔点比它的组成成分熔点低,硬度大,能灵活运用质量守恒定律回答问题.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 浓硫酸倒在皮肤上,可用氢氧化钠溶液中和 | |
| B. | 进入深井前做灯火实验 | |
| C. | 肥皂水可区分硬水和软水 | |
| D. | 长时间用盐水浸泡铁制品除铁锈 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 生石灰属于氧化物 | B. | 小苏打属于盐 | ||
| C. | 酒精属于有机物 | D. | 干冰属于混合物 |
| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | B. | CO+CuO$\frac{\underline{\;加热\;}}{\;}$CO2+Cu | ||
| C. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO | D. | Na2CO3+Ca(OH)2═CaCO3↓+2NaOH |
| A. | 钨的熔点高,可以用来制作保险丝 | |
| B. | 不锈钢抗锈性能好,可用于作外科手术刀 | |
| C. | 石灰石在高温作用下分解,可用于制备生石灰 | |
| D. | 一氧化碳气体具有可燃性,可用于作气体燃料 |
| A. |  在某一密闭容器内点燃红磷 | |
| B. |  加热一定量氯酸钾和二氧化锰的固体混合物 | |
| C. |  向一定量石灰石中滴加稀盐酸 | |
| D. |  向氢氧化钠溶液中不断加水,溶液pH与加入水的质量关系 |
【提出问题】铁锈与盐酸反应的快慢受哪些因速的影响呢?
【猜想与假设】a.可能与盐酸的质量分数有关;
b.可能与反应的温度有关.
【设计实验】用相同质量的铁锈和足量的盐酸进行如表实验.
| 实验编号 | 盐酸的质量分数 | 反应的速度 | 铁锈消失的时间 |
| ① | 6% | 20℃ | 240 s |
| ② | 10% | 20℃ | 115 s |
| ③ | 10% | 30℃ | 75 s |
(2)要比较温度对反应快慢的影响,应选择的实验编号是②③.
【得出结论】(3)从以上实验中可得出的结论是①温度越高,反应时间越短,反应速率越快;②酸的溶质质量分数越大,反应速率越快.
【实验拓展】(4)随后在铁锈与盐酸反应的试管中加入少量硫酸,发现反应明显加快,可能是硫酸中H+(填化学符号)加快了反应的速率,请设计一个合理的实验来验证你的假设在铁锈与盐酸反应的试管中加入少量硫酸钠溶液,发现反应速率没有改变,说明不是其中的硫酸根离子所起的作用.
(5)铁锈与盐酸反应的快慢可能还受哪些因速影响?设计实验验证.
