题目内容
10.将一小块银白色的金属钠放置在空气中会发生下列变化:钠(Na) $\stackrel{O_{2}}{→}$钠的氧化物$\stackrel{H_{2}O}{→}$ 氢氧化钠溶液 $\stackrel{CO_{2}}{→}$白色固体
【提出问题】:常温下钠与氧气反应,产物有哪些?
【查阅资料】:钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:
Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
【作出猜想】:常温下钠与氧气反应的产物.
猜想1:Na2O,
猜想2:Na2O2,
猜想3:Na2O和Na2O2
【实验探究一】:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | 没有气泡生成 | 猜想1正确 |
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验探究二】:
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量氯化钙溶液 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.过滤、取少量滤液加入无色的酚酞试液 | 变成红色 |
(1)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为O2.
(3)久置的固体氢氧化钠变质的原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O.
分析 【作出猜想】根据钠与氧气反应的产物进行猜想;
【实验探究一】:根据氧化钠与水反应的现象分析;
【实验探究二】:根据碳酸钠、氢氧化钠的性质、检验方法分析回答;
【实验反思】(1)根据质量守恒定律分析X的化学式;
(3)根据氢氧化钠与二氧化碳反应生成碳酸钠和水,从而使氢氧化钠变质进行解答.
解答 解:【作出猜想】由于钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),所以猜想三是:Na2O和Na2O2;
【实验探究一】:由于氧化钠与水反应生成了氢氧化钠,所以,取少量钠的氧化物加入足量蒸馏水,现象是没有气泡生成,证明猜想一正确;
【实验探究二】:由于碳酸钠与足量的氯化钙反应生成了碳酸钙和氯化钠,溶液呈中性,氢氧化钠能使酚酞试液变红色.所以.填表如下:
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量 氯化钙溶液 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.过滤、取少量滤液加入 无色的酚酞试液 | 变成红色 |
【实验反思】(1)由质量守恒定律反应后原子的种类及数目不变可知,方程式得到右边还缺少两个氧原子,所以,分析X的化学式是:O2.
(2)氢氧化钠与二氧化碳反应生成碳酸钠和水.该反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.故答案为:2NaOH+CO2═Na2CO3+H2O.
故答为:【作出猜想】Na2O和Na2O2;
【实验探究一】:没有气泡生成;
【实验探究二】:
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量 氯化钙溶液 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.过滤、取少量滤液加入 无色的酚酞试液 | 变成红色 |
点评 该题根据查阅资料提供的信息并结合实验步骤和现象解决问题.主要考查读题能力,能把题目所给信息与所学知识进行牵连.知道性质决定用途,用途体现性质.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
1.5月某校举行了科技文化节,在这次科技文化节上初三级化学研究小组没计了如下挑战项目:通过实验鉴别两种无色溶液和两种白色固体,已知它们分别是稀盐酸、氯化钠溶液、CaO和 CaCO3中的一种.现场仅提供了蒸馏水以及常用的实验仪器.请设计一个完成该挑战项目的实验方案,写出实验步骤,预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 分别取两种白色固体少量与两支试管中分别滴入蒸馏水,观察, | 不能溶解的为碳酸钙, 溶解且产生热量是氧化钙, |
| 取碳酸钙,分别滴加两种无色溶液 | 有气泡产生的为稀盐酸,无现象的为氯化钠 |
19.“物质是由分子和原子构成的.”据此说明化学变化的基础是( )
| A. | 原子的破裂 | |
| B. | 分子的破裂 | |
| C. | 分子中原子的重新组合 | |
| D. | 分子、原子同时破裂,重新组合成新的分子和原子 |
2.下列检验或除去气体杂质的方法正确的是( )
| A. | 检验二氧化碳气体可以用燃着的木条 | |
| B. | 除去二氧化碳气体中少量的一氧化碳,可以向混合气体中通入氧气 | |
| C. | 除去一氧化碳中少量的二氧化碳可以将混合气体通过灼热的碳粉 | |
| D. | 检验某混合气体中是否含有氧气可以用带火星的木条 |
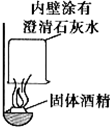 某校化学兴趣小组的同学在一次聚餐中,发现并对燃料固体酒精产生了好奇,于是对其成分进行了探究.
某校化学兴趣小组的同学在一次聚餐中,发现并对燃料固体酒精产生了好奇,于是对其成分进行了探究.

 将一个充满二氧化碳的试管倒立在盛有紫色石蕊溶液的烧杯中,一段时间后可以观察到的现象是:(1)试管内上升一段液柱;紫色石蕊试液变红;
将一个充满二氧化碳的试管倒立在盛有紫色石蕊溶液的烧杯中,一段时间后可以观察到的现象是:(1)试管内上升一段液柱;紫色石蕊试液变红;