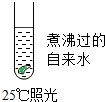
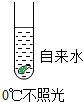
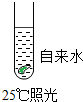
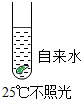
题目内容
3.某研究小组欲检验草酸晶体样品分解产物,并测定样品中草酸晶体的质量分数(假设杂质不参与反应).草酸晶体(H2C2O4•2H2O )的部分理化性质见下表:| 熔 点 | 沸 点 | 热 稳 定 性 | 与 碱 反 应 |
| 101℃~102℃ | 150℃~160℃ 升华 | 100.1℃分解出水,175℃分解成CO2、CO、H2O | 与 Ca(OH)2反应产生白色沉淀(CaC2O4) |
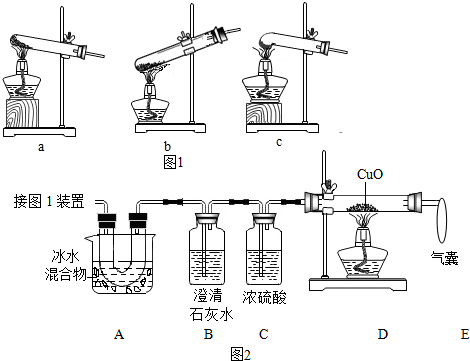
(2)图2是验证热分解产物中含 CO、CO2的装置.
①装置A的主要作用是除去草酸蒸气,防止对二氧化碳的检验产生干扰.
②气囊的作用是收集未反应的一氧化碳,防止空气污染.
③证明存在CO2的现象是B装置内的澄清石灰水变浑浊,B中反应的化学方程式CO2+Ca(OH)2═CaCO3↓+H2O.
④证明存在CO的现象是D装置中黑色固体变红.
(3)为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,称量装置D反应前后的质量差.由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因:一氧化碳没有全部与氧化铜反应.(写一条即可)
(4)称取17.5g草酸晶体样品配制50.00g溶液,加适量的稀硫酸,然后滴加KMnO4溶液(含KMnO47.9克)恰好反应完全.(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)
请计算样品中草酸晶体(H2C2O4•2H2O )的质量分数.(写出计算过程)
[有关物质的相对分子质量:Mr(H2C2O4)=90,Mr(H2C2O4•2H2O)=126,Mr(KMnO4)=158].
分析 (1)根据草酸晶体的熔点较低,受热容易熔化进行解答;
(2)①根据除去草酸蒸气,防止对二氧化碳的检验产生干扰进行解答;
②根据一氧化碳有毒,污染空气解答;
③根据二氧化碳能使澄清的石灰水变浑浊进行解答;
④根据一氧化碳的还原性可以进行相关方面的判断;
(3)一氧化碳部分反应,生成的铜重新被氧化等因素都能够导致计算出的实验结果比实际值偏低;
(4)根据高锰酸钾的质量求出样品中草酸的质量,进而求出晶体的质量以及样品中草酸晶体(H2C2O4•2H2O )的质量分数即可.
解答 解:(1)草酸的熔点较低,受热容易熔化,用c装置加热草酸时不容易下流,适宜用来加热草酸;
(2)①A的作用是除去草酸蒸气,防止对二氧化碳的检验产生干扰;
②因为一氧化碳有毒,污染空气,气囊的作用是收集未反应的一氧化碳,防止空气污染;
③二氧化碳能使澄清的石灰水变浑浊,证明存在CO2的现象是:澄清的石灰水变浑浊,二氧化碳和石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
④证明存在CO的现象是:D中黑色固体变成红色.
(3)一氧化碳部分反应,生成的铜重新被氧化等因素都能够导致计算出的实验结果比实际值偏低;
(4)设草酸晶体的质量为x.
由2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O可知,
5H2C2O4•2H2O→5H2C2O4→2KMnO4
630 316
x 7.9g
$\frac{630}{x}=\frac{316}{7.9g}$
x=15.75g
样品中草酸晶体(H2C2O4•2H2O )的质量分数=$\frac{15.75g}{17.5g}×100%$=90%
答:样品中草酸晶体(H2C2O4•2H2O )的质量分数为90%.
故答案为:
(1)c;
(2)①除去草酸蒸气,防止对二氧化碳的检验产生干扰;
②收集未反应的一氧化碳,防止空气污染;
③B装置内的澄清石灰水变浑浊;CO2+Ca(OH)2═CaCO3↓+H2O;
④D装置中黑色固体变红;
(3)一氧化碳没有全部与氧化铜反应;
(4)90%.
点评 本题涉及化学方程式的书写、实验现象的判断、根据化学方程式进行计算等方面的知识,是典型的综合题.

 阅读快车系列答案
阅读快车系列答案| A. | 生石灰可用来干燥过氧化氢溶液(又称双氧水)制得的氧气 | |
| B. | 打开浓盐酸的瓶盖,见到瓶口出现白雾现象 | |
| C. | 氢氧化钠不能用来治疗胃酸过多症 | |
| D. | 紫色石蕊遇到稀酸变为红色 |
(1)金属大规模被使用的先后顺序跟③(填序号)选项关系最大.
①地壳中金属元衷的含量 ②金属的导电性 ③金属的活动性
(2)为探究锰与铁的金属活动性,在相同温度下,取大小相同的两种金属薄片,用砂纸将表面擦光亮,分别投入等体积、等溶质质量分数的足量稀盐酸中反应,观察现象.请分析回答下列问题:
①两种金属投入盐酸前用砂纸将表面擦光亮,其主要目的是A.
A.除去氧化膜,便于直接反应 B.使表面不平整,易反应
C.表面光亮,易观察 D.提高金属温度,加快反应速度
②根据下表中的现象填写结论.
| 金属 | 铁 | 锰 |
| 与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度较快 |
| 结论 | 锰的金属活泼性大于铁. | |
(3)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的镁和铁,待反应停止后,请判断:
①若天平仍保持平衡,烧杯中一定没有剩余的物质是稀盐酸.
②若天平失去平衡,则指针一定偏向放铁的一边.
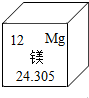 元素周期表是化学学习的工具.如图是镁元素在周期表中的表示,下列有关镁元素的信息不正确的是( )
元素周期表是化学学习的工具.如图是镁元素在周期表中的表示,下列有关镁元素的信息不正确的是( )| A. | 原子序数是12 | B. | 它是金属元素 | ||
| C. | 原子结构示意图为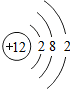 | D. | 镁的相对原子质量是24.305 g |
 在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数.以下是几组同学的设想及做法:
在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数.以下是几组同学的设想及做法:
 如图所示是镁原子的结构示意图,根据图示回答:镁原子在化学变化中容易失去(填“得到”或“失去”)电子,成为离子,镁离子的符号是Mg2+.
如图所示是镁原子的结构示意图,根据图示回答:镁原子在化学变化中容易失去(填“得到”或“失去”)电子,成为离子,镁离子的符号是Mg2+.