题目内容
2.人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为铜、铁、铝.(1)金属大规模被使用的先后顺序跟③(填序号)选项关系最大.
①地壳中金属元衷的含量 ②金属的导电性 ③金属的活动性
(2)为探究锰与铁的金属活动性,在相同温度下,取大小相同的两种金属薄片,用砂纸将表面擦光亮,分别投入等体积、等溶质质量分数的足量稀盐酸中反应,观察现象.请分析回答下列问题:
①两种金属投入盐酸前用砂纸将表面擦光亮,其主要目的是A.
A.除去氧化膜,便于直接反应 B.使表面不平整,易反应
C.表面光亮,易观察 D.提高金属温度,加快反应速度
②根据下表中的现象填写结论.
| 金属 | 铁 | 锰 |
| 与盐酸反应现象 | 放出气泡速度缓慢 | 放出气泡速度较快 |
| 结论 | 锰的金属活泼性大于铁. | |
(3)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的镁和铁,待反应停止后,请判断:
①若天平仍保持平衡,烧杯中一定没有剩余的物质是稀盐酸.
②若天平失去平衡,则指针一定偏向放铁的一边.
分析 (1)金属活动性较弱时,难形成化合物,常以单质形式存在,比较容易被利用;金属的活动性越强,就越难把它制成单质,使用的就晚.
(2)只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,根据这一规律可以设计实验来验证金属的活动性顺序.
(3)金属和酸溶液发生置换反应生成氢气的多少即和金属的质量有关,也和酸的质量有关,关键看哪一种物质全部参与化学反应,根据化学方程式的计算所带入物质的质量必须是这种物质全部参与化学反应.
解答 解:(1)在金属活动性顺序中,化学性质越活泼的金属越易和空气中的成分发生化学变化,因此主要以化合物的形式存在于自然界中,就越难以发现,所以,金属大规模被使用的先后顺序跟金属的活动性的关系最大.
(2)①由于金属易与空气的氧气反应生成金属氧化物,两种金属投入盐酸前用砂纸将表面擦光亮,其主要目的是除去氧化膜,便于直接反应;
②由于铁和稀盐酸反应时放出气泡的速率慢,说明锰的金属活泼性大于铁;
③验证金属的活动性顺序,除了使用金属和酸溶液反应外,也可以采用金属和盐溶液,例如,可以使用FeSO4、Mn(或Fe、Mn(NO3)2).
(3)①若天平仍保持平衡,说明得到的氢气一样多,则稀盐酸全部参与化学反应,即金属是足量的;
②若天平失去平衡,说明得到的氢气不一样多,而等质量的镁和铁应是镁得到的氢气多,则指针一定偏向放铁的一边.
故答为:(1)③;(2)①A;②锰的金属活泼性大于铁;③FeSO4、Mn;(3)①稀盐酸;②铁.
点评 本题难度不是很大,主要考查了金属和酸溶液的反应,根据得到的氢气的多少来推测参与反应的物质的信息,从而培养学生的分析问题的能力.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
12.推理是学习化学的一种重要方法,下列推理中,正确的是( )
| A. | 某固体物质加入稀盐酸能产生气体,则该固体一定是“氢前”的金属 | |
| B. | 给水通直流电可以产生氢气和氧气,则水是由氢气和氧气组成的 | |
| C. | 溶液具有均一、稳定的特征,所以均一、稳定的物质一定是溶液 | |
| D. | 碱性溶液能使酚酞试液变红,则能使酚酞试液变红的一定是碱性溶液 |
10.鉴别①NaCl ②MgSO4③CuCl2④NaOH四种溶液,不用其它试剂,则被鉴别出来物质的顺序正确的是( )
| A. | ②③④① | B. | ③④①② | C. | ③②④① | D. | ①③②④ |
7. “尾气催化转换器”是将汽车尾气中的有毒气体转变为无毒气体.其微观过程如图所示,其中不同的圆球代表不同的原子.下列说法中正确的是( )
“尾气催化转换器”是将汽车尾气中的有毒气体转变为无毒气体.其微观过程如图所示,其中不同的圆球代表不同的原子.下列说法中正确的是( )
 “尾气催化转换器”是将汽车尾气中的有毒气体转变为无毒气体.其微观过程如图所示,其中不同的圆球代表不同的原子.下列说法中正确的是( )
“尾气催化转换器”是将汽车尾气中的有毒气体转变为无毒气体.其微观过程如图所示,其中不同的圆球代表不同的原子.下列说法中正确的是( )| A. | 反应物和生成物全部是化合物 | B. | 生成物的分子个数之比为2:l | ||
| C. | 反应物的分子个数之比为2:3 | D. | 反应前后原子、分子的个数不变 |
3.某研究小组欲检验草酸晶体样品分解产物,并测定样品中草酸晶体的质量分数(假设杂质不参与反应).草酸晶体(H2C2O4•2H2O )的部分理化性质见下表:
(1)图1是加热装置.最适宜的加热分解草酸晶体装置是c.
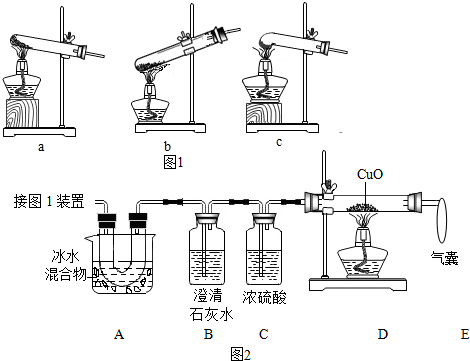
(2)图2是验证热分解产物中含 CO、CO2的装置.
①装置A的主要作用是除去草酸蒸气,防止对二氧化碳的检验产生干扰.
②气囊的作用是收集未反应的一氧化碳,防止空气污染.
③证明存在CO2的现象是B装置内的澄清石灰水变浑浊,B中反应的化学方程式CO2+Ca(OH)2═CaCO3↓+H2O.
④证明存在CO的现象是D装置中黑色固体变红.
(3)为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,称量装置D反应前后的质量差.由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因:一氧化碳没有全部与氧化铜反应.(写一条即可)
(4)称取17.5g草酸晶体样品配制50.00g溶液,加适量的稀硫酸,然后滴加KMnO4溶液(含KMnO47.9克)恰好反应完全.(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)
请计算样品中草酸晶体(H2C2O4•2H2O )的质量分数.(写出计算过程)
[有关物质的相对分子质量:Mr(H2C2O4)=90,Mr(H2C2O4•2H2O)=126,Mr(KMnO4)=158].
| 熔 点 | 沸 点 | 热 稳 定 性 | 与 碱 反 应 |
| 101℃~102℃ | 150℃~160℃ 升华 | 100.1℃分解出水,175℃分解成CO2、CO、H2O | 与 Ca(OH)2反应产生白色沉淀(CaC2O4) |

(2)图2是验证热分解产物中含 CO、CO2的装置.
①装置A的主要作用是除去草酸蒸气,防止对二氧化碳的检验产生干扰.
②气囊的作用是收集未反应的一氧化碳,防止空气污染.
③证明存在CO2的现象是B装置内的澄清石灰水变浑浊,B中反应的化学方程式CO2+Ca(OH)2═CaCO3↓+H2O.
④证明存在CO的现象是D装置中黑色固体变红.
(3)为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,称量装置D反应前后的质量差.由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因:一氧化碳没有全部与氧化铜反应.(写一条即可)
(4)称取17.5g草酸晶体样品配制50.00g溶液,加适量的稀硫酸,然后滴加KMnO4溶液(含KMnO47.9克)恰好反应完全.(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)
请计算样品中草酸晶体(H2C2O4•2H2O )的质量分数.(写出计算过程)
[有关物质的相对分子质量:Mr(H2C2O4)=90,Mr(H2C2O4•2H2O)=126,Mr(KMnO4)=158].
4.下列物质属于纯净物的是( )
| A. | 水 | B. | 盐酸 | C. | 碘酒 | D. | 生铁 |