题目内容
3.大自然中学化学兴趣小组的息赫同学发现实验室里有一变质的氢氧化钠样品,为测定其中碳酸钠的含量,他进行了如下实验:
反应①结束后,所加氢氧化钡溶液刚好反应了一半,反应②恰好完全反应,请回答下列问题:
(1)反应①的化学方程式为Ba(OH)2+Na2CO3=2 NaOH+BaCO3↓;
(2)根据已知条件列出求解碳酸钠质量(x)的比例式:$\frac{106}{x}=\frac{197}{19.7g}$;
(3)样品中碳酸钠的质量分数为56.9%(保留一位小数);
(4)所加氢氧化钡溶液中溶质的质量分数为34.2%;
(5)所加硫酸钠溶液的溶质质量分数是14.2%;
(6)溶液A中溶质的质量分数为6.7%.
分析 (1)该实验氢氧化钡和碳酸钠反应生成碳酸钡沉淀和氢氧化钠,根据质量守恒定律正确书写化学方程式;
(2)根据化学方程式中各物质的质量比分析解答;
(3)根据化学方程式,结合沉淀的质量来计算出碳酸钠的质量即可解答;
(4)根据化学方程式,结合沉淀的质量来计算出氢氧化钡的质量即可解答;
(5)根据化学方程式,结合沉淀的质量来计算出消耗硫酸钠的质量即可解答;
(6)根据反应后溶液A中溶质是氢氧化钠解答.
解答 解:(1)氢氧化钡和碳酸钠反应生成碳酸钡沉淀和氢氧化钠,化学方程式为:Ba(OH)2+Na2CO3=2 NaOH+BaCO3↓;
设碳酸钠的质量为x,氢氧化钡的质量为y,根据质量守恒定律,产生碳酸钡沉淀的质量为:18.6g+64.4g+100g-163.3g=19.7g
Ba(OH)2+Na2CO3=2 NaOH+BaCO3↓;
171 106 197
y x 19.7g
$\frac{171}{y}=\frac{197}{19.7g}$
y=17.1g
$\frac{106}{x}=\frac{197}{19.7g}$
x=10.6g
(3)样品中碳酸钠的质量分数为:$\frac{10.6g}{18.6g}×$100%≈56.9%
(4)反应①结束后,所加氢氧化钡溶液刚好反应了一半,所加氢氧化钡溶液中溶质的质量分数为:$\frac{17.1g}{50g}×$100%=34.2%
(5)50g氢氧化钡溶液中溶质质量为17.1g,设加硫酸钠溶液的溶质质量为z,生成硫酸钡的质量为w,生成氢氧化钠的质量为a
Ba(OH)2+Na2SO4=2NaOH+BaSO4↓
171 142 80 233
17.1g z a w
$\frac{171}{17.1g}=\frac{142}{z}$
z=14.2g
$\frac{171}{17.1g}=\frac{233}{w}$
w=23.3g
$\frac{171}{17.1g}=\frac{80}{a}$
a=8g
所加硫酸钠溶液的溶质质量分数是$\frac{14.2g}{100g}×$100%=14.2%
(6)样品中氢氧化钠钠的质量=18.6g-10.6g=8g
溶液A中溶质的质量分数=$\frac{8g+8g}{163.3g+100g-23.3g}×$100%≈6.7%
答案:
(1)Ba(OH)2+Na2CO3=2 NaOH+BaCO3↓;
(2)$\frac{106}{x}=\frac{197}{19.7g}$
(3)56.9%
(4)34.2%
(5)14.2%
(6)6.7%
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案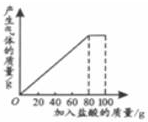 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象. | 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
(2)实验中所用的稀盐酸中,溶质的质量分数是多少?
| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 | 第7次 | 第8次 | |
| 稀硫酸的质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 生成气体的质量/g | 0 | 0 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.5 |
(2)请计算:①10g该镁条中含镁的质量;②若加入20g稀硫酸后立即开始产生气体,求实验所用稀硫酸中溶质的质量分数.
| A. | 用甲醛浸泡虾仁 | |
| B. | 发现煤气泄漏时,立即打开排气扇电源开关 | |
| C. | 家用电器着火时,立即用水扑灭 | |
| D. | 治疗胃酸过多症,可服用含氢氧化铝的药物 |