题目内容
11.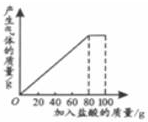 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象. | 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
(2)实验中所用的稀盐酸中,溶质的质量分数是多少?
分析 (1)由图表分析,三次参加反应的物质质量相等,由此计算出第二次参加反应的物质质量,再由剩余固体的质量=总质量-参加反应的物质质量可计算出a的值;
(2)根据题意和图表分析,可得到样品中CaCO3的质量,由化学方程式可得到各物质的质量比,列出比例式计算出石灰石样品完全反应产生二氧化碳的质量.
解答 解:
(1)由图象可知,第四次加入盐酸后,才得到完全反应,故在反应过程中,第一次充分反应后剩余固体的质量为30g,说明只有35g-30g=5g样品参与了反应,第三次充分反应后剩余固体的质量为20g,说明共有35g-20g=15g样品参与了反应,故第二次充分反应时,也只有5g样品参与了反应,故第2次加入盐酸后,a为35g-5g×2=25g;
(2)由题可知,每20g盐酸消耗的碳酸钙的质量为5g,设20g盐酸中含有溶质质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
5g x
$\frac{100}{73}=\frac{5g}{x}$ x=3.65g
故盐酸的质量分数为:$\frac{3.65g}{20g}×100%=18.25%$
答:所用的稀盐酸中溶质的质量分数是18.25%.
点评 本题要求学生了解完全反应和不完全反应的概念及特点,观察图表,分析数据,正确解答.

练习册系列答案
相关题目
1.生活中处处有化学.当面对下列问题时,处理方式错误的是( )
| A. | 公路上的积雪用氯化钠消除 | |
| B. | 把海产品放入甲醛溶液中保鲜 | |
| C. | 胃酸过多,服用胃舒平(主要称为为氢氧化铝) | |
| D. | 碱面涩口,加食醋改良口感 |
2.下列物质中,属于纯净物的是( )
| A. | 澄清的石灰水 | B. | 新鲜的空气 | C. | 不锈钢 | D. | 水蒸气 |
16.某水泥厂新进一批石灰石原料,该厂检验室为了测定该石灰石中碳酸钙的质量分数,取该样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸但也不溶于水)有关实验数据如表:(假设烧杯的质量为82g)
(1)反应中生成二氧化碳的质量为4.4g;
(2)求该石灰石中碳酸钙的质量分数(结果保留一位小数);
(3)反应后生成溶液的溶质的质量分数是多少?(结果保留一位小数)
| 反应前 | 反应后 | ||
| 实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 152.0g | 12.0g | 159.6g | |
(2)求该石灰石中碳酸钙的质量分数(结果保留一位小数);
(3)反应后生成溶液的溶质的质量分数是多少?(结果保留一位小数)
6.化学用语是学习化学的重要工具,对下列化学用语叙述正确的是( )
| A. | NH3中N元素显-3价 | B. | 4N表示4个氮元素 | ||
| C. | Mg+2表示镁离子 | D. | 氧化铁的化学式为Fe2O3 |
 如图所示为某种加钙食盐包装标签上的部分文字.请仔细阅读后回答以下问题:
如图所示为某种加钙食盐包装标签上的部分文字.请仔细阅读后回答以下问题:
 如图是初中化学中常见物质间的转化关系,图中“→”表示转化关系,“-”表示相互能反应,反应条件间和部分物质已省略.已知A是胃酸的主要成分,D可用于配置波尔多液,其中A+B→C+F+G,A+N→C+F+G,请回答下列问题.
如图是初中化学中常见物质间的转化关系,图中“→”表示转化关系,“-”表示相互能反应,反应条件间和部分物质已省略.已知A是胃酸的主要成分,D可用于配置波尔多液,其中A+B→C+F+G,A+N→C+F+G,请回答下列问题.