题目内容
12.微粒观是重要的物质科学观念.请你从①质子数;②中子数;③电子数;④分子;⑤最外层电子数;⑥原子;⑦离子;选项中选择序号填空.(1)相对原子质量约为①与②之和.
(2)元素的种类主要取决于原子的①.
(3)原子中一定相等的是①与③.
(4)化学变化中⑥不变④一定变.
分析 根据已有的物质的构成、原子的构成以及分子和原子之间的关系进行分析解答即可.
解答 解:(1)相对原子质量约为质子数与中子数之和,故填:①;②;
(2)元素的种类主要取决于原子的质子数,故填:①;
(3)原子中一定相等的是质子数与电子数,故填:①;③;
(4)化学变化的实质是分子分成原子,原子重新组合成新的分子,所以化学变化中原子不变、分子一定变,故填:⑥;④.
点评 掌握物质的构成和原子构成以及微粒的作用是解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.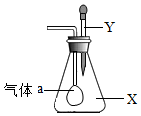 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y可能是( )
 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y可能是( )| A. | X是CO2,Y是氢氧化钠 | B. | X是O2,Y是稀H2SO4(稀硫酸) | ||
| C. | X是N2,Y是稀盐酸 | D. | X是CO,Y是氢氧化钠 |
4.控制变量是科学探究的重要方法之一.小华同学实验中发现:把质量相等的不同物质放入同样一杯水中,有的溶解快,有的溶解多,有的溶解又快又多.是哪些因素影响着物质溶解的快慢与多少呢?
请你参考下表硝酸钾的溶解度随温度的变化关系,以硝酸钾为例,选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:
(1)建立假设:温度影响硝酸钾溶解快慢;
(2)实施方案:
a.取两只小烧杯分别加入2g硝酸钾;b.在其中的一只烧杯中加入10毫升的冷水,另一只烧杯中加入10毫升的热水;c.比较相同条件下,溶解相同质量的硝酸钾固体所需要的时间;
(3)预测实验结果热水中的硝酸钾溶解的快;
实验中,控制不变的因素是硝酸钾的质量、水的体积(至少写出2点).
请你参考下表硝酸钾的溶解度随温度的变化关系,以硝酸钾为例,选择一种可能影响硝酸钾溶解快慢的因素设计实验进行探究:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(g) | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 168 |
(2)实施方案:
a.取两只小烧杯分别加入2g硝酸钾;b.在其中的一只烧杯中加入10毫升的冷水,另一只烧杯中加入10毫升的热水;c.比较相同条件下,溶解相同质量的硝酸钾固体所需要的时间;
(3)预测实验结果热水中的硝酸钾溶解的快;
实验中,控制不变的因素是硝酸钾的质量、水的体积(至少写出2点).
1.稀土金属是我国战略性资源,应加以保护.稀土金属钇(Y)是很活泼的金属常见化合价为+3价.它是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: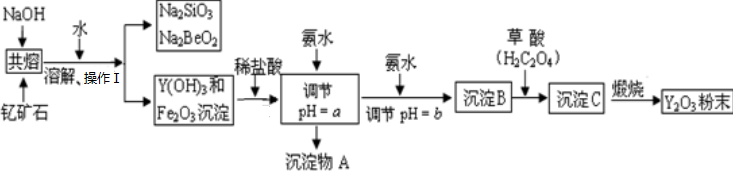
资料卡:①有关金属离子形成氢氧化物沉淀时的pH如下表:
②铁离子遇到KSCN溶液会呈现血红色
(1)已知钇矿石中Be为+2价,Si为+4价,则Fe的化合价为+2;
(2)操作Ⅰ是过滤;
(3)加盐酸时,发生的中和反应的方程式为:Y(OH)3+3HCl═YCl3+3H2O;
(4)调节pH=a,则a应控制在3.7~6.0的范围内,检验Fe3+是否沉淀完全的操作方法是取溶液适量于试管中,滴加KSCN溶液,如果溶液呈现血红色,说明铁离子没有完全沉淀,如果溶液呈现无色,说明铁离子完全沉淀.

资料卡:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)已知钇矿石中Be为+2价,Si为+4价,则Fe的化合价为+2;
(2)操作Ⅰ是过滤;
(3)加盐酸时,发生的中和反应的方程式为:Y(OH)3+3HCl═YCl3+3H2O;
(4)调节pH=a,则a应控制在3.7~6.0的范围内,检验Fe3+是否沉淀完全的操作方法是取溶液适量于试管中,滴加KSCN溶液,如果溶液呈现血红色,说明铁离子没有完全沉淀,如果溶液呈现无色,说明铁离子完全沉淀.


 在一烧杯中盛有由Na2CO3和NaCl 组成的固体混合物25g,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示(已知反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O).请分析曲线图后回答下列问题:
在一烧杯中盛有由Na2CO3和NaCl 组成的固体混合物25g,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示(已知反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O).请分析曲线图后回答下列问题: