题目内容
1.稀土金属是我国战略性资源,应加以保护.稀土金属钇(Y)是很活泼的金属常见化合价为+3价.它是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: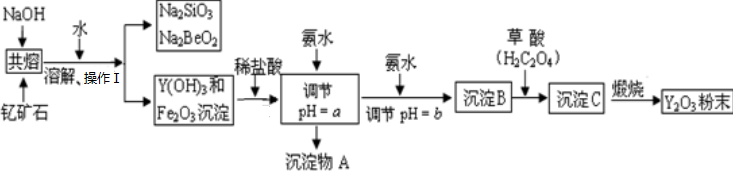
资料卡:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)已知钇矿石中Be为+2价,Si为+4价,则Fe的化合价为+2;
(2)操作Ⅰ是过滤;
(3)加盐酸时,发生的中和反应的方程式为:Y(OH)3+3HCl═YCl3+3H2O;
(4)调节pH=a,则a应控制在3.7~6.0的范围内,检验Fe3+是否沉淀完全的操作方法是取溶液适量于试管中,滴加KSCN溶液,如果溶液呈现血红色,说明铁离子没有完全沉淀,如果溶液呈现无色,说明铁离子完全沉淀.
分析 (1)化合物中元素化合价代数和为零;
(2)操作Ⅰ是过滤,通过过滤能够把固体和液体分离;
(3)酸和碱反应生成盐和水,属于中和反应;
(4)根据离子形成沉淀的pH,可以判断溶液的pH应该调节的范围;
根据铁离子的性质,可以判断Fe3+是否沉淀完全的检验方法.
解答 解:(1)已知钇矿石中Be为+2价,Si为+4价,Y为+3价,O为-2,设Fe的化合价为x,
根据题意有:(+3)×2+x+(+2)×2+(+4)×2+(-2)×10=0,
x=+2,
故填:+2.
(2)操作Ⅰ是过滤,通过过滤能够把固体和液体分离.
故填:过滤.
(3)加盐酸时,发生的中和反应的方程式为:Y(OH)3+3HCl═YCl3+3H2O.
故填:Y(OH)3+3HCl═YCl3+3H2O.
(4)由题意可知,调节pH=a是为了使铁离子以氢氧化铁形式沉淀析出,则a应控制在3.7~6.0的范围内;
检验Fe3+是否沉淀完全的操作方法是:取溶液适量于试管中,滴加KSCN溶液,如果溶液呈现血红色,说明铁离子没有完全沉淀,如果溶液呈现无色,说明铁离子完全沉淀.
故填:3.7~6.0;取溶液适量于试管中,滴加KSCN溶液,如果溶液呈现血红色,说明铁离子没有完全沉淀,如果溶液呈现无色,说明铁离子完全沉淀.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
6.为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是( )
| 选项 | 物质 | 操作方法 |
| A | Fe(Fe2O3) | 加入过量稀盐酸,充分反应后过滤 |
| B | CaO粉末(CaCO3粉末) | 加足量的水,充分搅拌后过滤 |
| C | NaOH溶液(Ca(OH)2溶液) | 通入过量CO2气体,充分反应后过滤 |
| D | CuSO4溶液(硫酸) | 加入过量CuO粉末,加热,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
10.维生素A有维生素A1(C20H3lO)和维生素A2 (C20H28O).下列说法不正确的是( )
| A. | 维生素A可以预防夜盲症 | |
| B. | 1个维生素A1分子比1个维生素A2分子多2个原子 | |
| C. | 维生素A1和维生素A2组成元素相同,化学性质也相同 | |
| D. | 维生素A1中氧元素比维生素A2中元素质量分数低 |


 为测定空气里氧气的含量,甲、乙二个同学用如图所示的装置分别进行了实验探究.
为测定空气里氧气的含量,甲、乙二个同学用如图所示的装置分别进行了实验探究. 人类的生活、生产离不开水.
人类的生活、生产离不开水.