题目内容
14. 某课外小组的同学把饱和碳酸氢钠溶液误当成稀硫酸,加到盛有镁条的试管中,镁条完全溶解,有无色气体和白色不溶物生成.于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如下探究.
某课外小组的同学把饱和碳酸氢钠溶液误当成稀硫酸,加到盛有镁条的试管中,镁条完全溶解,有无色气体和白色不溶物生成.于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如下探究.探究一:产生的无色气体是什么物质?
| 实验序号 | 实验操作 | 实验现象 | 解释及结论 |
| 实验I | 用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 | 迅速反应,产生大量气体M和白色不溶物N | / |
| 实验Ⅱ | 将气体M点燃,并在火焰上方罩一干、冷的小烧杯 | 气体安静燃烧、产生淡蓝色火焰,烧杯内壁有水雾出现. | 该气体M是H2,燃烧的化学方程式为 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O. |
【查阅资料】
1.碱石灰是固体氢氧化钠和氧化钙的混合物.
2.MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
【猜想与假设】
①N可能为Mg(OH)2;②N可能为MgCO3;③N可能是Mg(OH)2和MgCO3的混合物.
实验Ⅲ:
(1)取白色不溶物N适量,加入足量的稀盐酸溶液,观察到固体N全部溶解,产生无色气泡,则白色固体N中一定含有碳酸镁.
(2)称取干燥、纯净的白色不溶物N适量,充分加热至不再产生气体,并将气体全部通入如图装置中(假设每一步骤均进行完全).
(3)实验数据
| 装置A的质量 | 装置B的质量 | |
| 通入气体前 | 292.4g | 198.2g |
| 通入气体后 | 294.2g | 207.0g |
①装置B的作用为吸收生成的二氧化碳,装置C的作用为防止空气中的二氧化碳进入B.
②若上述该白色不溶物N的组成用xMg(OH)2•yMgCO3表示,则x:y=1:2.
分析 实验Ⅱ:迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变分析出是氢气,再根据方程式的写法写出方程式;
[猜想与假设]根据题中信息进行猜想解答;
实验Ⅲ:(1)加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;
(4)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,根据二氧化碳的质量计算出碳酸镁的质量,剩余的就是氢氧化镁的质量;
解答 解:
实验Ⅱ:迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气;氢气燃烧的反应物是氢气和氧气,生成物是水,反应条件是点燃,所以方程式是:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
[猜想与假设](1)N可能为Mg(OH)2
(2)N可能为MgCO3
(3)N可能是Mg(OH)2 和MgCO3的混合物;
实验Ⅲ:(1)加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是稀盐酸(或稀硫酸),有气泡产生,说明含有碳酸镁;
(4)①装置B的作用为吸收生成的二氧化碳;装置C的作用为防止空气中的二氧化碳进入B;
②氢氧化镁受热分解为水和氧化镁;A增重的质量即为生成水的质量,生成水的质量=294.2g-292.4g=1.8g
设生成1.8g水需要氢氧化镁的质量为x
Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O
58 18
x 1.8g
$\frac{58}{x}=\frac{18}{1.8g}$
x=5.8g
B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为207.0g-198.2g=8.8g,设生成8.8g二氧化碳,需要碳酸镁的质量为y则:
MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑
84 44
y 8.8g
$\frac{84}{y}=\frac{44}{8.8g}$
x=16.8g
因此Mg (OH)2 与MgCO3的质量比为5.8g:16.8g=29:84;该白色不溶物质N的组成用xMg (OH)2•yMgCO3表示,则x:y=$\frac{29}{58}:\frac{84}{84}$=1:2.
答案:
实验Ⅱ:
H2; 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
探究二:②Mg(OH)2 和MgCO3的混合物;
实验Ⅲ:(1)稀盐酸; 碳酸镁;
(4)①吸收生成的二氧化碳; 防止空气中的二氧化碳进入B;
②1:2
点评 本题难度较大,考查全面,从定性和定量两个方面测定物质的种类,关键在于知道碳酸根离子与酸反应能产生二氧化碳.关键在于知道氢氧化镁加热分解为水.

 阅读快车系列答案
阅读快车系列答案| A. | NaOH、Na2CO3、酚酞、CaCl2 | B. | 稀HCl、Na2CO3、BaCl2、Na2SO4 | ||
| C. | Na2SO4、Ba(OH)2、KNO3、NaCl | D. | CuSO4、NaOH、BaCl2、KNO3 |
 向一定质量Mg(NO3)2、AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )
向一定质量Mg(NO3)2、AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,下列说法正确的是( )| A. | a点溶液中的溶质有3种 | |
| B. | c点溶液中溶质为Mg(NO3)2、Zn(NO3)2、AgNO3 | |
| C. | 若取b~c段溶液,滴加稀盐酸,有白色沉淀 | |
| D. | 取d点的固体,加入稀盐酸,有气泡产生 |
| 反应前 | 反应后 |  | ||
| A | B | C | D | |
 |  |  |  | |
| A. | 该反应属于复分解反应 | B. | 该反应中元素的化合价没有变化 | ||
| C. | 该反应中生成物的质量比为1:1 | D. | 该反应中的化合物都属于氧化物 |
| A. | 钙、铁是人体中不可缺少的常量元素 | |
| B. | 金属活动性顺序表是金属活动性的判断依据 | |
| C. | 从元素周期表中可以确定该元素在自然界中的含量 | |
| D. | 碱和盐中一定含有金属元素 |
 在Cu+的作用下可将乙烯(C2H4)和烟气混合除去其中的二氧化硫,其反应过程如图所示,下列说法错误的是( )
在Cu+的作用下可将乙烯(C2H4)和烟气混合除去其中的二氧化硫,其反应过程如图所示,下列说法错误的是( )| A. | Cu+在反应中其催化作用 | |
| B. | 该反应属于化合反应 | |
| C. | 反应前后氧原子的个数没有发生改变 | |
| D. | 利用该反应可减少酸雨的危害 |
| A. |  淮南大米 | B. |  黄山臭桂鱼 | ||
| C. |  萧县葡萄 | D. |  长江螃蟹 |
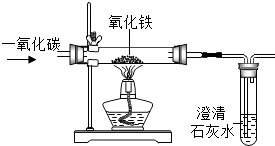 实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是( )
实验室里,用如图所示装置还原氧化铁的过程中,可能生成四氧化三铁、氧化亚铁或铁等固体物质.关于该实验,下列说法错误的是( )| A. | 实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 | |
| B. | 实验结束时,玻璃管中红色的氧化铁粉末变成黑色,该产物不一定是铁 | |
| C. | 反应后,玻璃管中的固体物质的质量比反应前减少了,证明一定有铁生成 | |
| D. | 为了减少空气污染,应增加尾气处理装置 |