题目内容
9.下列有关说法中正确的是( )| A. | 钙、铁是人体中不可缺少的常量元素 | |
| B. | 金属活动性顺序表是金属活动性的判断依据 | |
| C. | 从元素周期表中可以确定该元素在自然界中的含量 | |
| D. | 碱和盐中一定含有金属元素 |
分析 A、根据人体中常量元素和微量元素所包括的种类,进行分析判断;.
B、根据金属活动性顺序的意义分析解答;
C、根据元素在自然界的含量是通过计算的出来的,进行解答;
D、碱是指电离时生成的阴离子全部是氢氧根离子的化合物.盐是指由金属离子和酸根离子组成的化合物.
解答 解:A、人体中微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒,铁、锌、碘元素都属于人体必需微量元素,钙属于人体必需的常量元素故选项说法错误;
B、从金属活动性顺序表可以知道金属活泼性的强弱,正确;
C、根据元素在自然界的含量是通过计算的出来的,所以根据元素周期表不能判断元素在自然界的含量;故B错误;
D、盐和碱中不一定含有金属元素,如氯化铵和氨水,故错误;
故选:B.
点评 掌握化学基本知识是正确解答本题的关键,完成此题,需要加强对课本基础知识的储备,以便灵活应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列指定反应的化学方程式正确的是( )
| A. | 检验氢气时发生爆鸣:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2H2O | |
| B. | 铁片溶于稀硫酸:2Fe+3H2SO4═Fe2(SO4)3+3H2↑ | |
| C. | 实验室制取二氧化碳:CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ | |
| D. | 氢氧化钠吸收NO2、NO生成亚硝酸钠和水:2NaOH+NO2+NO═2NaNO3+H2O |
14. 某课外小组的同学把饱和碳酸氢钠溶液误当成稀硫酸,加到盛有镁条的试管中,镁条完全溶解,有无色气体和白色不溶物生成.于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如下探究.
某课外小组的同学把饱和碳酸氢钠溶液误当成稀硫酸,加到盛有镁条的试管中,镁条完全溶解,有无色气体和白色不溶物生成.于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如下探究.
探究一:产生的无色气体是什么物质?
探究二:产生的白色不溶物N是什么物质?
【查阅资料】
1.碱石灰是固体氢氧化钠和氧化钙的混合物.
2.MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
【猜想与假设】
①N可能为Mg(OH)2;②N可能为MgCO3;③N可能是Mg(OH)2和MgCO3的混合物.
实验Ⅲ:
(1)取白色不溶物N适量,加入足量的稀盐酸溶液,观察到固体N全部溶解,产生无色气泡,则白色固体N中一定含有碳酸镁.
(2)称取干燥、纯净的白色不溶物N适量,充分加热至不再产生气体,并将气体全部通入如图装置中(假设每一步骤均进行完全).
(3)实验数据
(4)实验分析
①装置B的作用为吸收生成的二氧化碳,装置C的作用为防止空气中的二氧化碳进入B.
②若上述该白色不溶物N的组成用xMg(OH)2•yMgCO3表示,则x:y=1:2.
 某课外小组的同学把饱和碳酸氢钠溶液误当成稀硫酸,加到盛有镁条的试管中,镁条完全溶解,有无色气体和白色不溶物生成.于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如下探究.
某课外小组的同学把饱和碳酸氢钠溶液误当成稀硫酸,加到盛有镁条的试管中,镁条完全溶解,有无色气体和白色不溶物生成.于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如下探究.探究一:产生的无色气体是什么物质?
| 实验序号 | 实验操作 | 实验现象 | 解释及结论 |
| 实验I | 用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 | 迅速反应,产生大量气体M和白色不溶物N | / |
| 实验Ⅱ | 将气体M点燃,并在火焰上方罩一干、冷的小烧杯 | 气体安静燃烧、产生淡蓝色火焰,烧杯内壁有水雾出现. | 该气体M是H2,燃烧的化学方程式为 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O. |
【查阅资料】
1.碱石灰是固体氢氧化钠和氧化钙的混合物.
2.MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
【猜想与假设】
①N可能为Mg(OH)2;②N可能为MgCO3;③N可能是Mg(OH)2和MgCO3的混合物.
实验Ⅲ:
(1)取白色不溶物N适量,加入足量的稀盐酸溶液,观察到固体N全部溶解,产生无色气泡,则白色固体N中一定含有碳酸镁.
(2)称取干燥、纯净的白色不溶物N适量,充分加热至不再产生气体,并将气体全部通入如图装置中(假设每一步骤均进行完全).
(3)实验数据
| 装置A的质量 | 装置B的质量 | |
| 通入气体前 | 292.4g | 198.2g |
| 通入气体后 | 294.2g | 207.0g |
①装置B的作用为吸收生成的二氧化碳,装置C的作用为防止空气中的二氧化碳进入B.
②若上述该白色不溶物N的组成用xMg(OH)2•yMgCO3表示,则x:y=1:2.
19.为了验证二氧化碳与水反应生成碳酸,小赵做了以下实验,不合理的是( )
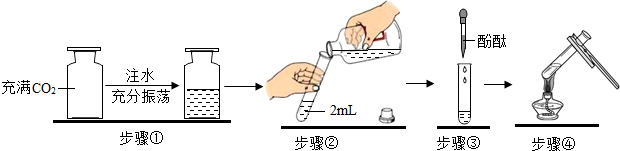

| A. | 步骤① | B. | 步骤② | C. | 步骤③ | D. | 步骤④ |
 如图所示,A~H是初中化学常见的物质.A和B可发生中和反应,A是胃酸的主要成分,X常用作食品干燥剂,Y为单质.根据图示回答下列问题:
如图所示,A~H是初中化学常见的物质.A和B可发生中和反应,A是胃酸的主要成分,X常用作食品干燥剂,Y为单质.根据图示回答下列问题: 如图所示,底面积为80cm2的玻璃杯放在水平桌面上,装满水后的玻璃杯和水的总质量是150g,将质量为9g的树脂眼镜放进杯里,溢出水后,测得玻璃杯、树脂眼镜和水的总质量是154g.树脂镜片主要成分的化学式为(C6H3OHCH2)n,则该成分中碳、氢元素的质量比为14:1.
如图所示,底面积为80cm2的玻璃杯放在水平桌面上,装满水后的玻璃杯和水的总质量是150g,将质量为9g的树脂眼镜放进杯里,溢出水后,测得玻璃杯、树脂眼镜和水的总质量是154g.树脂镜片主要成分的化学式为(C6H3OHCH2)n,则该成分中碳、氢元素的质量比为14:1.