题目内容
17.下列说法正确的是( )| A. | 3g碳在100g氧气中充分燃烧生成103g二氧化碳 | |
| B. | 100mL98%的浓硫酸用100mL水稀释,可得到溶质质量分数为49%的硫酸 | |
| C. | 用含杂质(杂质不与酸反应,也不溶于水)的铁10g 和50g 稀硫酸完全反应后,滤去杂质,所得液体质量为55.4g,则含杂质的铁中铁的质量分数为56% | |
| D. | MgO与CuO的混合物与98g10%的稀硫酸恰好完全反应,则原混合物中氧元素的质量是1.6g |
分析 A、根据碳和氧气反应的化学方程式确定参加反应的碳和氧气的质量比,进行分析判断.
B、根据溶液稀释前后,溶质的质量不变,结合题意进行分判断.
C、随着铁与硫酸的反应,溶液的质量逐渐增加,根据反应的化学方程式,判断出溶液增加量与参加反应铁的质量关系,即可由反应前后溶液的增加求出样品中含铁的质量,从而求得样品中杂质的质量分数.
D、根据MgO与CuO与稀硫酸反应的化学方程式结合硫酸的质量,根据氧元素的质量守恒来完成解答.
解答 解:A、碳和氧气反应生成二氧化碳,反应的化学方程式为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,参加反应的碳和氧气的质量比12:(16×2)=12:32,即3g碳与8g氧气恰好完全反应,生成11g二氧化碳,故选项说法错误.
B、溶液稀释前后,溶质的质量不变,水的密度为1g/ml,100mL水的质量为100g,而浓硫酸的密度大于1g/ml,100mL浓硫酸的质量大于100g,故稀释后溶质的质量分数应大于49%,故选项说法错误.
C、设参加反应铁的质量为x
Fe+H2SO4═FeSO4+H2↑ 溶液质量增加
56 2 56-2=54
x 55.4g-50g=5.4g
$\frac{56}{54}$=$\frac{x}{5.4g}$,x=5.6g
则样品中杂质的质量分数=$\frac{5.6g}{10g}$×100%=56%,故选项说法正确.
D、MgO与CuO与稀硫酸反应的化学方程式为:MgO+H2SO4═MgSO4+H2O;CuO+H2SO4═CuSO4+H2O,由于MgO与CuO的混合物与98g10%的稀硫酸恰好完全反应,分析化学方程式可以知道硫酸根中氧元素没有发生改变,依然在硫酸根中,而MgO与CuO中的氧元素则转变为水中的氧元素,即混合物中氧元素的质量和水中氧元素的质量相等,由方程式可得硫酸与水及氧元素的关系式为H2SO4~H2O~O
生成水中氧元素质量是x,则
H2SO4~H2O~O
98 16
98g×10% x
$\frac{98}{16}$=$\frac{9.8g}{x}$
解得:x=1.6g,故选项说法正确.
故选:CD.
点评 本题难度不大,掌握质量守恒定律、溶液稀释前后溶质的质量不变等并能灵活运用是正确解答本题的关键.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
(1)图中仪器名称是②锥形瓶,⑧集气瓶.
(2)小宝同学用氯酸钾和二氧化锰制取并收集一瓶氧气,应选择上图中的仪器①④⑤⑨(或①④⑥⑦)(填序号,以下同),其化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;验证瓶中氧气已集满的方法是将带火星的木条放到瓶口,如果木条复燃,则已收满.
(3)小茹同学用锌和稀硫酸制取H2,同时生成硫酸锌,则应选择上图中②③⑥⑦装置,其化学方程式为:Zn+H2SO4═ZnSO4+H2↑.
(4)小佳同学查阅资料得到制取硫化氢气体的如下信息,请回答下列问题:
| 气体 | 实验药品 | 反应条件 | 气体物理性质 |
| H2S | 硫化亚铁固体与稀硫酸 | 不需加热 | 无色,密度比空气大,可溶于水 |
②制取硫化氢可以(填“可以”或“不可以”)采用装置②和③,理由是反应物是固体和液体,且反应不需要加热.

 A~G均为初中化学中常见的物质:其中A、C组成元素相同,E是红色单质.如图是它们之间的转化关系,请回答:
A~G均为初中化学中常见的物质:其中A、C组成元素相同,E是红色单质.如图是它们之间的转化关系,请回答: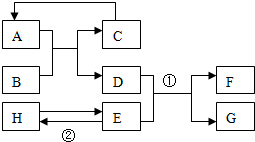 已知A-H均为初中化学常见的物质,其中A、C是组成元素相同的气体,且C能产生温室效应:是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀.根据如图所示的转化关系(图中反应条件均已略去),请回答:
已知A-H均为初中化学常见的物质,其中A、C是组成元素相同的气体,且C能产生温室效应:是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀.根据如图所示的转化关系(图中反应条件均已略去),请回答:
 A、B、C、D、E、F为初中化学常见物质,A、B两溶液发生中和反应,固体C常用于改良酸性土壤,且C和D反应可制得B;E、F的物质类别相同,且F能与A溶液发生反应,已知上述物质间存在如图所示的关系(“→”表示转化关系,“-”表示反应关系).
A、B、C、D、E、F为初中化学常见物质,A、B两溶液发生中和反应,固体C常用于改良酸性土壤,且C和D反应可制得B;E、F的物质类别相同,且F能与A溶液发生反应,已知上述物质间存在如图所示的关系(“→”表示转化关系,“-”表示反应关系).